Câncer de Mama: Alterações Epigenéticas Iniciais na Reprogramação Metabólica
Breast Cancer: Early Epigenetic Alterations in Metabolic Reprogramming
Parte 1 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente em Biomedicina, São Luís, MA – Brasil.
Foco em pesquisa translacional na área de bioquímica do câncer de mama, investigando mecanismos moleculares, vias de sinalização celular e reprogramação metabólica.
Endereço para correspondência (Para ajudar financeiramente a manter este canal).
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
O câncer de mama é a neoplasia de maior incidência em mulheres de todo o mundo, com uma alta taxa de mortalidade devido ao grande desenvolvimento de metástases no organismo (característica de grande expressão neste tipo de células tumorais, que conseguem facilmente atravessar a matriz extracelular e se estabelecer em outros tecidos de maneira sustentável). Devido à importância epidemiológica dessa doença, vários estudos já foram realizados em diversas áreas da célula, buscando compreender todos os processos diferenciados que atuam na carcinogênese e/ou tumorgênese e que, consequentemente, levam ao seu desenvolvimento com uma alta taxa de proliferação e perfil extremamente agressivo.
Diversas características diferenciadas já foram comprovadas, como o fato de que diversas alterações no funcionamento do metabolismo da célula de mama são necessárias para que o seu desenvolvimento seja sustentável. O metabolismo tumoral foi descrito por Otto Warburg em 1920, onde ele afirma que células cancerosas metabolizam glicose de forma diferente das células normais através da glicólise aeróbica. Devido a dados de pesquisas recentes, testificou-se que as alterações também ocorrem no metabolismo lipídico, indicando uma reprogramação do metabolismo celular.
Entretanto, e apesar de (haverem se passado) 90 anos depois da descoberta feita por Warburg, os estudos ainda não conseguiram esclarecer por completo como o metabolismo tumoral funciona e são direcionados mais para o campo genético, desconsiderando a importância de estudos do funcionamento metabólico da célula. Tendo em vista este cenário, esse estudo foi feito com o principal objetivo de documentar o que já foi comprovado e discutir sobre esses resultados obtidos, sugerindo uma nova técnica de investigação.
Palavras-chave: câncer de Mama, Metabolismo, Metabolismo-Celular, Reprogramação-Metabólica,Alterações-EpigenéticasA
Abstract
Abstract
Breast cancer is the most prevalent neoplasm among women worldwide, with a high mortality rate due to the extensive development of metastases throughout the body (a characteristic strongly expressed in this type of tumor cell, which can readily cross the extracellular matrix and establish themselves sustainably in other tissues). Owing to the epidemiological importance of this disease, numerous studies have been conducted in different cellular contexts, aiming to understand the distinct processes involved in carcinogenesis and/or tumorigenesis that ultimately lead to its development with a high proliferation rate and an extremely aggressive profile.
Several distinctive features have already been demonstrated, such as the fact that multiple alterations in breast cell metabolism are required to sustain tumor development. Tumor metabolism was described by Otto Warburg in 1920, when he proposed that cancer cells metabolize glucose differently from normal cells through aerobic glycolysis. Based on recent research data, it has also been demonstrated that alterations occur in lipid metabolism, indicating a reprogramming of cellular metabolism.
However, despite more than 90 years having passed since Warburg’s discovery, studies have not yet fully elucidated how tumor metabolism functions and have been predominantly directed toward the genetic field, often overlooking the importance of investigating cellular metabolic function. In view of this scenario, the present study was conducted with the primary objective of documenting what has already been demonstrated and discussing the results obtained, while suggesting a new investigative technique.
Keywords: Breast cancer; Metabolism; Cellular metabolism; Metabolic reprogramming; Epigenetic Alterations
Introdução
Câncer é um conjunto de doenças que apresentam a característica de um crescimento aumentado e desordenado de células, colocando-se como as principais causas de morte em todo o mundo.
O aparecimento dos tumores pode ocorrer em várias partes do corpo com um grande acúmulo de fatores alterados no DNA (fatores carcinogênicos), Cerca de 5% a 10% dos cânceres são causados por mutações herdadas, que são transmitidas de pais para filhos, mais a maioria são adquiridas ao longo da vida, desencadeado pôr exposição a agentes externos, como radiação ou produtos químicos, que culminam em alterações diferenciada na expressão de diferentes proteínas importantes para supressão tumoral, reparo do DNA e regulação de diferentes ciclos na celula (genes de supressão tumoral) e também genes de reparo do DNA.
O câncer de mama é a quinta maior causa de morte por câncer e a principal entre as mulheres em todo o mundo, correspondendo a 522 mil mortes ao ano. Essa alta taxa de mortalidade está associada ao aparecimento de metástases, e essa “patologia” tumoral e apresenta a característica mais agressiva dessa doença, pois consegue facilmente atravessar a matriz extracelular e alcançar a circulação sanguínea e/ou linfática, formando novos tumores no organismo.
Para uma melhor compreensão dos mecanismos celulares e moleculares que originam as células cancerígenas e a sua metástase, é necessária uma organização linear dos estudos já comprovados dos processos bioquímicos que permitem o nascimento das células tumorais e a sua estabilidade, sobrevivência e multiplicação. Também buscando compreender a representação de cada mutação genética na reprogramação do metabolismo celular e como a célula consegue adquirir nutrientes específicos do sangue, viabilizando a disseminação de células cancerosas do tumor original para outras partes do corpo, formando novos tumores.
Um tumor sólido funciona como um sistema metabolicamente reprogramado, caracterizado pela presença de múltiplos microambientes distintos. Esses nichos incluem áreas com hipóxia, baixo pH, necrose e privação de nutrientes típicos do metabolismo normal. Para garantir sua sobrevivência diante da carência ou excesso de elementos essenciais, o tumor ativa vias metabólicas intermediárias e diferenciadas. Esse processo de adaptação obedecer às normas bioquímicas pré-definidas na regulação padrão, permitindo que a reprogramação metabólica se mantenha em um estado de funcionamento equilibrado e resiliente.
É fundamental reconhecer que toda escolha na vida acarreta um custo ou uma consequência. Em outras palavras, cada ação desencadeia uma reação — nem sempre o resultado pretendido, mas, muitas vezes, um desdobramento administrável dentro do contexto da situação.
Ou seja. Qual é o objetivo principal da célula de mama (sobreviver ou se reproduzir)?
O objetivo principal em um contexto de dificuldade imposta, do ponto de vista biológico e evolutivo, é sobreviver. A sobrevivência é a condição fundamental que permite, em um momento posterior, a reprodução. Sem a preservação da própria vida, a reprodução torna-se impossível.
Embora a reprodução descontrolada da célula indique como o objetivo, em uma situação de crise ou dificuldade imediata, o instinto e os mecanismos de um organismo se concentram em superar a ameaça existencial imediata. A prioridade máxima é garantir a segurança e a função do organismo o tempo suficiente para que a oportunidade de se reproduzir possa surgir mais tarde, quando as condições forem mais favoráveis.
As células operam sob um regime de fornecimento contínuo de nutrientes, utilizando complexos sistemas de controle e regulação. Esses mecanismos, que atuam de forma direta ou indireta, são cruciais para manter o funcionamento celular constante e estabilizado, prevenindo tanto a proliferação descontrolada quanto a metástase no organismo.
As mutações genéticas nas células tumorais reconfiguram o funcionamento padrão das vias metabólicas e de sinalização. Essa alteração direciona as células cancerosas para um novo padrão de controle, permitindo-lhes absorver nutrientes eficientemente para satisfazer suas elevadas demandas energéticas. Elas sobrevivem mesmo diante de reagentes ou condições que alterariam o controle normal da nutrição em pontos específicos. Com o tempo, essas mutações no DNA produzem características que, por meio de desvios para processos não convencionais, atingem a mesma finalidade: garantir a sobrevivência. Tais desvios conferem vantagens que aumentam a chance de o organismo (neste contexto, o tumor) sobreviver e se reproduzir em um ambiente diferenciado. Esse processo, impulsionado pela seleção natural e pelo tempo de adaptação a novas condições de funcionamento e ambientais, contribui para uma evolução genética definitiva.
A seleção do substrato energético e a ativação da via metabólica são processos contingentes ao tipo celular, à disponibilidade de oxigênio, à demanda energética e à presença de cofatores e outras moléculas reguladoras. Há também uma dependência da disponibilidade do funcionamento correto da via sinalizada como sendo a preferencial. Pois, a precisão, a complexidade e a regulação multifacetada do metabolismo energético nas células destaca que a escolha do “combustível” (substrato energético, como glicose, gorduras ou proteínas) e a via metabólica ativada (como respiração aeróbica, fermentação, etc.) não são processos aleatórios, mas sim estritamente controlados por vários fatores inter-relacionados, caracterizando-se por promover programações metabólicas que se adaptam constantemente às condições internas e externas para manter a homeostase energética, tendo como a glicose o principal monossacarídeo utilizado para a rápida geração de adenosina trifosfato (ATP). A glicose, após a sua internalização celular, pode ser direcionada para o armazenamento (glicogênese) ou para a degradação oxidativa (glicólise e respiração celular), em função do estado metabólico, necessidade energética e das necessidades teciduais.
conclusão:
A programação metabólica e a definição genética em um determinado tempo, são estabelecidas pelos itens abaixo:
- Substrato energético: que Refere-se especificamente à molécula que será metabolizada para produzir energia (neste caso, a glicose).
- Ativação da via metabólica: Que Indicará o início de uma série de reações bioquímicas (via) para um propósito específico (como a produção de energia ou armazenamento) entre outros.
- Contingentes: Que dependem ou estão condicionados a outros fatores.
- Tipo celular: Reconhece a especificidade da célula, na sua forma de metabolizar.
- Disponibilidade de oxigênio: Que define se a via será aeróbica (respiração celular) ou anaeróbica (fermentação lática ou alcoólica).
- Demanda energética: A necessidade de ATP da célula em um dado momento do metabolismo.
- Cofatores e moléculas reguladoras: Fatores adicionais que modulam as reações enzimáticas.
- Monossacarídeo: A classificação bioquímica da glicose.
- Geração de adenosina trifosfato (ATP): A velocidade de produção de energia utilizável pela célula, suportando as demandas em cada processo do metabolismo.
- Internalização celular: Processo de entrada da glicose na célula.
- Síntese ou degradação do glicogênio: Para garantir que a célula mantenha a concentração mínima de glicose suportável para a produção de energia.
- Degradação oxidativa (glicólise e respiração celular: Processos de quebra da glicose (glicólise) e oxidação completa com uso de oxigênio (respiração celular) para liberação máxima de energia.
- Estado metabólico e necessidades teciduais: Expressões que englobam o contexto fisiológico geral do organismo e as necessidades específicas do tecido.
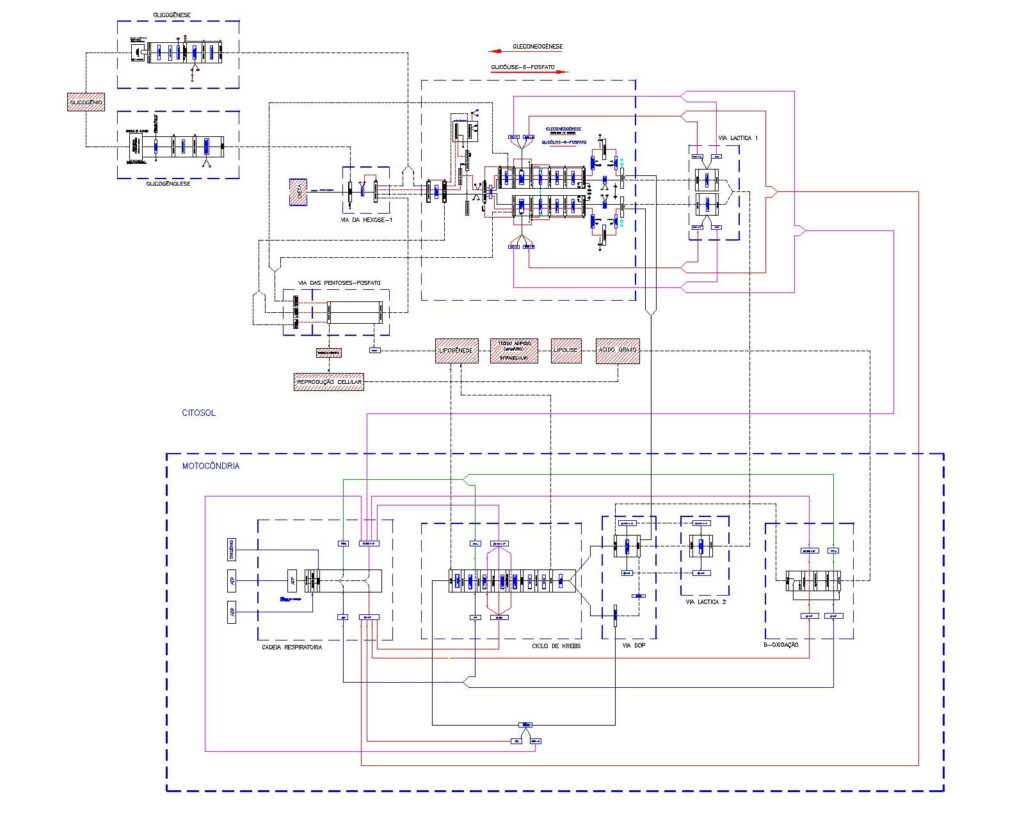
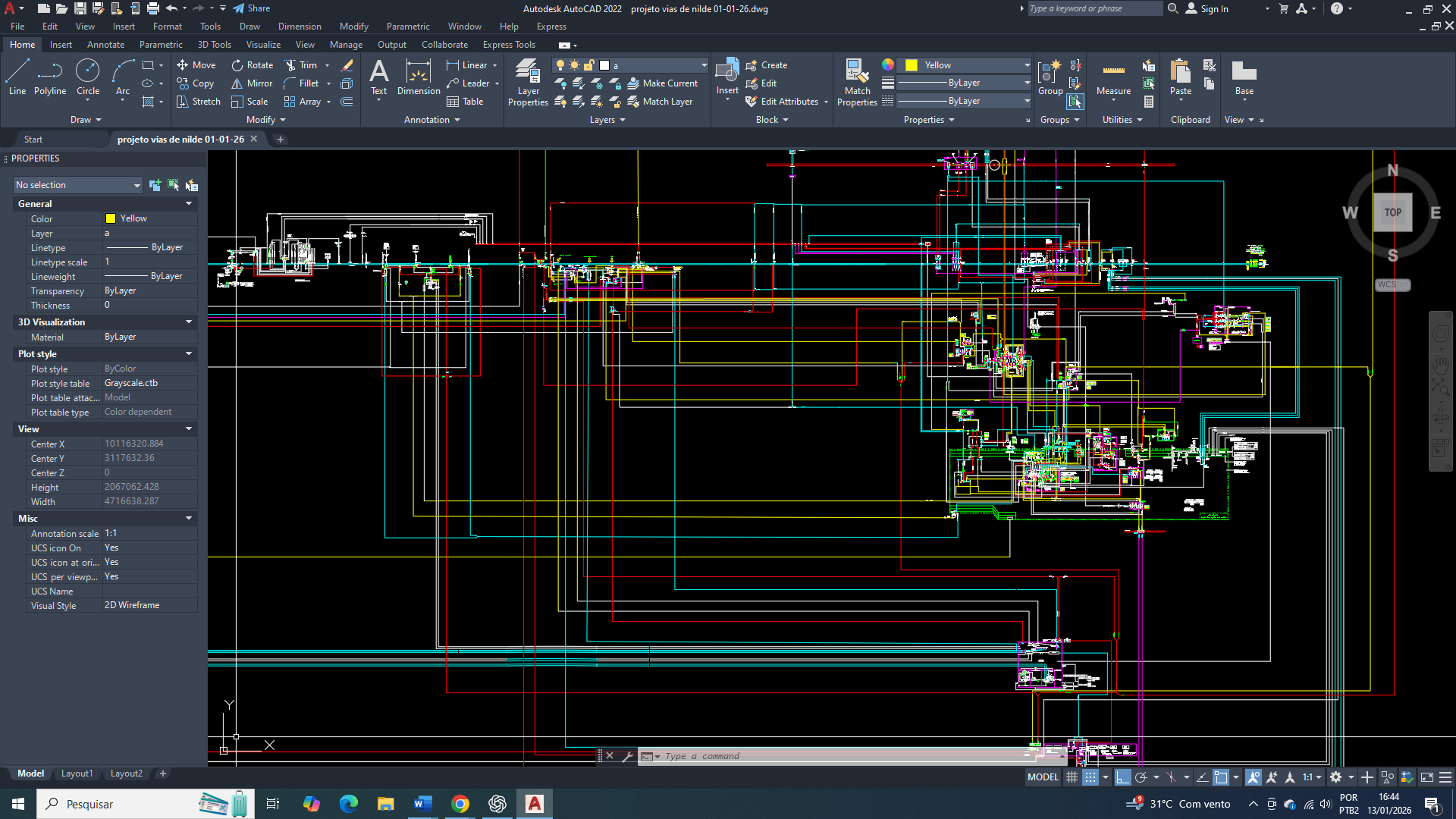
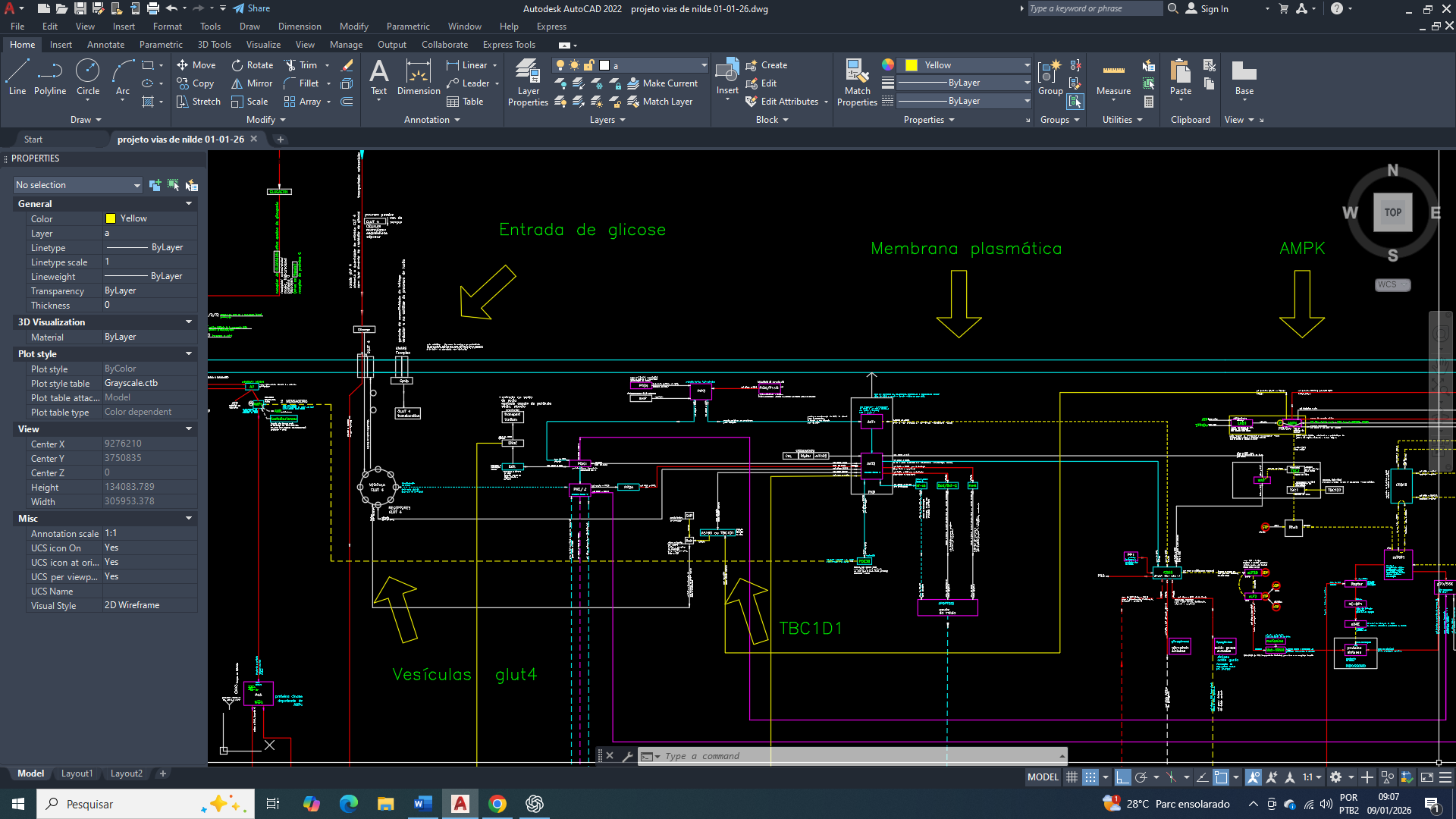
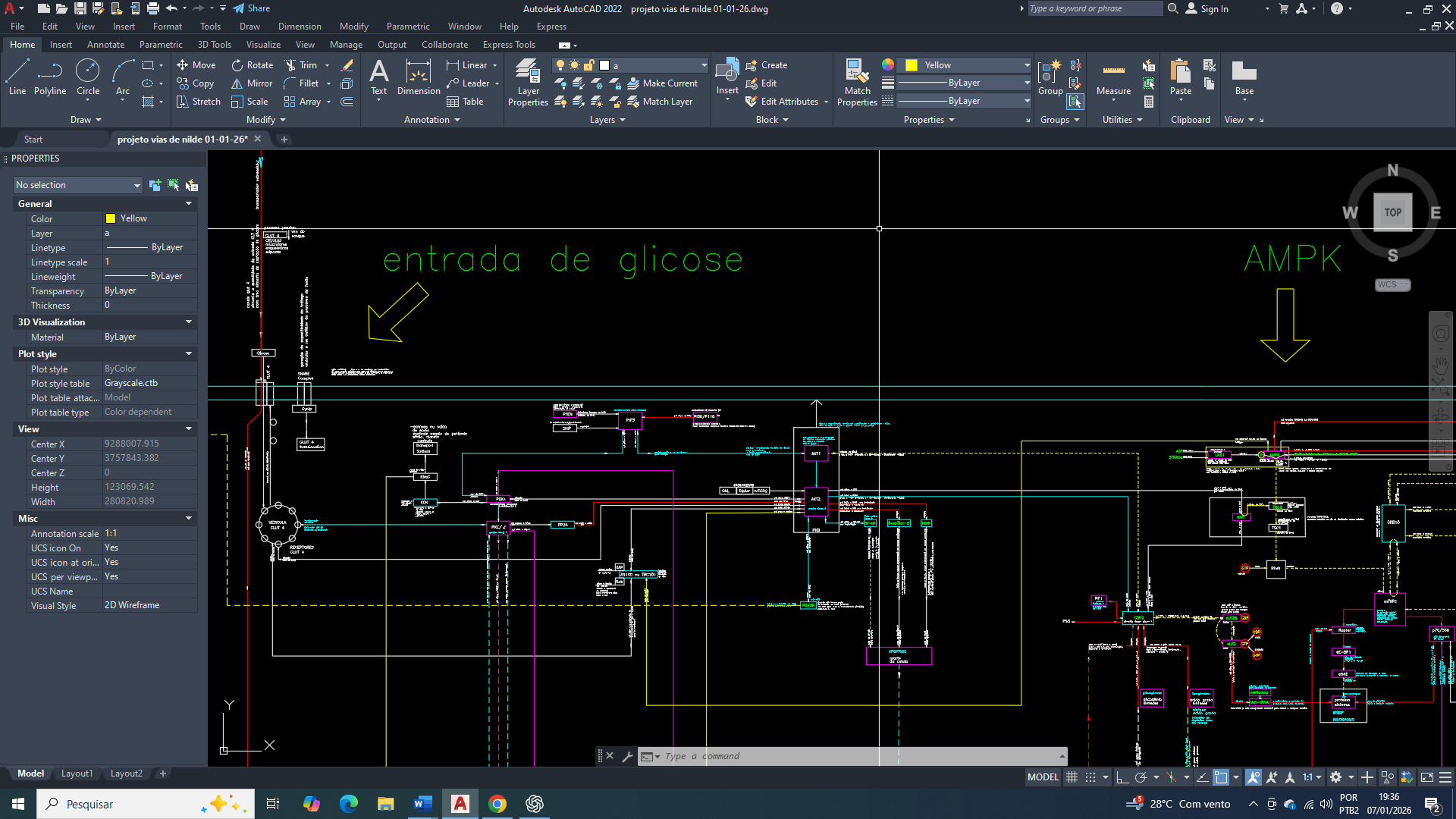
Diagrama/Esquema simplificado de interligações de vias para produção de energia (figura 1).
Apresentação do projeto vias de Nilde
Para elucidar, o porquê da reprogramação das diferentes células tumorais, é necessário montar o funcionamento celular de maneira linear e total. Não focado em pontos específicos, para atingir esse entendimento, para isso é necessário investir em inúmeros estudos internacionais (já comprovados), que visam mapear as alterações celulares que transformam tecidos saudáveis em tumorais. Analisando detalhadamente como tais mudanças atuam na formação de um nicho propício ao desenvolvimento do tumor e sua sustentabilidade e sobrevivência, em determinadas circunstâncias, na exacerbação de sua agressividade.
Destino dos carboidratos dentro da célula. – Os carboidratos simples (monossacarídeos), ao passarem para o meio intracelular, terão vários destinos: a. síntese de glicogênio, b. síntese de aminoácidos, c. produção de energia, d. via pentose fosfato e síntese de gordura. A definição dos caminhos dependerá da condição e necessidade energética e de nutrientes da célula e do corpo.
O metabolismo celular é um conjunto de reações bioquímicas que ocorrem com o objetivo de sintetizar biomoléculas (anabolismo) ou degradá-las (catabolismo), havendo, para isso, o consumo ou a produção de energia metabólica em forma de ATP — transformando nutrientes através da dieta e reservas internas na própria célula em energia e em moléculas necessárias para manter o seu funcionamento e função no organismo.
O anabolismo tem a função de utilizar moléculas simples para construir moléculas mais complexas, como a produção de proteínas, ácidos nucleicos ou reservas de nutrientes, tendo como sua principal característica realizar reações que requerem um fornecimento de energia (ATP-trifosfato de adenosina) para poder ocorrer (processos endergônicos).
- Exemplo: A síntese de proteínas, a partir de aminoácidos e informação genética, é um processo anabólico.
O catabolismo tem como função um conjunto de processos metabólicos que envolve a degradação e quebra de moléculas complexas em moléculas mais simples, como carboidratos, lipídios e proteínas, que são quebradas em unidades menores através de reações químicas. Durante essas reações, a energia armazenada nas ligações químicas dessas moléculas é liberada, e Parte dessa energia é capturada na forma de ATP, que pode ser utilizado para alimentar as atividades celulares que são dependentes de energia para acontecer. Portanto, a produção de ATP é uma das características principal do catabolismo, já que essa energia é essencial para diversas funções celulares e também a sua sobrevivência.
Exemplos: A respiração celular e a fermentação são exemplos de processos catabólicos que liberam energia dos nutrientes.
Obs. ATP (adenosina trifosfato), que é a principal molécula de energia utilizada pelas células.
Cinco processos funcionam em conjuntos de maneira direta e indireta:
- Os processos de catabolismo e anabolismo trabalham em conjunto e de forma regulada.
- A energia liberada pelo catabolismo é usada para impulsionar as reações anabólicas.
- Essa rede de reações metabólicas é fundamental para todas as funções celulares, desde a respiração até o crescimento e a reparação de tecidos.
Fases do Projeto vias de Nilde (entender o funcionamento):
A – Mecanismos Moleculares e Vias de Sinalização:
- Alterações no Metabolismo Celular: Estudo de como o metabolismo (glicólise, metabolismo lipídico, etc.) se altera e permanece com a progressão da doença (em células da mama).
- Disfunção Mitocondrial: Investigação do papel das mitocôndrias e do estresse oxidativo na evolução da doença.
- Vias de Sinalização Específicas: Análise de como a sinalização celular é afetada na reprogramação do metabolismo da célula de mama.
- Mecanismos de Morte Celular: Estudo do apoptose, autofagia e necrose na patogênese da doença.
B – Biomarcadores e Diagnóstico:
- Identificação de Biomarcadores Moleculares: Pesquisa e validação de proteínas, ácidos nucleicos (DNA, RNA) ou metabólitos que possam indicar estágios precoces ou a progressão da doença.
- Desenvolvimento de Métodos de Diagnóstico Laboratorial: Criação de novas metodologias para a dosagem de marcadores específicos, visando diagnósticos mais precisos e precoces.
- Perfil Bioquímico Específicos: Caracterização detalhada do perfil bioquímico das mutações genéticas, no funcionamento metabólico da célula de mama.
C – Fatores de Influência e Moduladores:
- Influência de Fatores Ambientais e Estilo de Vida: Análise bioquímica de como a dieta, exercícios, álcool ou toxinas ambientais modulam o início e a evolução da doença.
- Modulação Genética e Epigenética: Estudo de como a genética e as modificações epigenéticas (que não alteram a sequência de DNA, mas a expressão gênica) influenciam a suscetibilidade e a evolução da patologia.
- Interação com o Sistema Imunológico: Investigação das respostas imunes e inflamatórias na progressão da doença, e como a bioquímica pode explicar essas interações.
D – Apresentação do agente agressor que dará início ao nascimento do câncer de mama.
E – Apresentação da estratégia para eliminação total da célula cancerígena.
O plano B para não morrer por falta de energia também pode matar.
A reprogramação do metabolismo celular em sua essência biológica, não tem como “função” eliminar o seu hospedeiro; a morte é uma consequência da forma como as células cancerosas nascem, crescem e se espalham, prejudicando o funcionamento normal do organismo. Também Já e comprovado, que células cancerígenas não desempenham uma função útil ou necessária no organismo. mais são células do próprio corpo que depois da sua reprogramação metabólica, são mantidas definitivamente pôr vaias mutações genéticas por adaptações. Gerando três características principais:
A – Sobrevivência: alterando o controle do seu metabolismo. Devido uma anormalidade em uma parte da célula, gerando a possibilidade de parada total do sistema..
B – Uma interligação diferenciada com o sistema imunológico, em comparação com células normais.
C – A perda da capacidade de realizar suas funções normais, para economizar energia.
Todos esses padrões de funcionamento indicam que, inicialmente, a reprogramação do metabolismo celular já é pré-definida. Ou seja, é uma função com objetivo principal de sobrevivência da célula, caso houvesse uma alteração em um ponto específico, também provocando um padrão de funcionamento até que haja a restauração do local alterado (esse seria o plano ‘B’). Tudo isso funcionaria perfeitamente, a não ser que o local alterado se mantenha na condição diferenciada, gerando várias mutações genéticas por adaptações.
Também devemos levar em consideração que a ocorrência de múltiplas mutações genéticas de maneira instantânea em uma única célula a levaria ao colapso metabólico e à morte celular. Isso ocorre porque o metabolismo celular é uma rede complexa e interconectada de reações químicas controladas com precisão por enzimas e proteínas, cuja produção é ditada pelos genes.
Em resumo, a complexidade e a interdependência das vias metabólicas significam que múltiplas interrupções simultâneas excederiam a capacidade de adaptação ou reparo da célula, resultando em um colapso funcional. Também Deixando claro que mutações aleatórias impossibilita uma reprogramação controlada do sistema, pois não causariam padrões de funcionamento já são comprovados em cada tipo de câncer. inutilizando por completo a tese ser um “defeito aleatório no DNA” no sentido de um evento único e isolado, mas sim o resultado de um acúmulo de mutações genéticas no DNA que prejudicam os mecanismos de controle normais da célula, pois mantém a sua sobrevivência retirando a sua função. Mais ainda, obedecendo às principais leis de controle metabolico (já pré-definidas). Mascarando suas dificuldades em meio a outras com funcionamento normal, impedindo a atuação direta ou indireta do sistema imunológico. Permetindo por consequência o crescimento e divisão, formando tumores que invadem tecidos e órgãos vizinhos, em um processo conhecido como metástase.
Tudo isso Geram Mutações somáticas definitivas (adquiridas com o tempo): Ocorrem nas células do corpo e após a concepção (dando origem ao câncer). Inicialmente, essas mutações não são herdadas, mas podem se tornar hereditárias posteriormente se afetarem as células germinativa
Obs. O que múltiplas mutações instantâneas causariam:
- Falhas em Cascatas Enzimáticas: Se várias enzimas importantes do metabolismo (como as da respiração celular ou da síntese de proteínas) fossem afetadas simultaneamente, as vias metabólicas seriam interrompidas.
- Produção de Proteínas Não Funcionais: Mutações no DNA podem levar à produção de proteínas que não funcionam corretamente ou que são completamente inativas, tornando a célula incapaz de realizar funções vitais.
- Toxicidade Celular: O acúmulo de metabólitos intermediários que não podem ser processados devido a enzimas inativas pode atingir níveis tóxicos, envenenando a própria célula.
- Ativação da Morte Celular Programada (Apoptose): As células possuem mecanismos de reparo e controle de qualidade que, ao detectarem danos genéticos extensos e irreparáveis, iniciam a autodestruição para evitar o funcionamento defeituoso do organismo.

Representação simplificadas das áreas de controle primários da Programação do Metabolismo e também às entradas e saídas de substratos na Celular, visando a Sobrevivência (figura 3).
A variação na produção de NADH e FADH2 pelo Ciclo de Krebs é uma função do seu metabolismo, que ocorre em diferentes situações metabólicas:
- Falta de reagentes: A ausência de acetil-CoA (derivado do piruvato) interrompe a alimentação do ciclo (falta de alimentação).
- Bloqueio enzimático: O bloqueio da enzima aconitase no ciclo de Krebs que impede o avanço das reações e a produção de moléculas. Esta condição faz parte da sua função, mas só ocorre por consequência de condições de regulagem de outras enzimas no ciclo de Krebs (excesso de energia no metabolismo).
- Bloqueio da reciclagem das coenzimas: A falta de oxigênio impede a reciclagem do NADH e FADH2, o que para o ciclo (falta de oxigênio).
Mas esta situação em uma célula cancerígena de mama (é diferenciada):
- Não há ausência de acetil-CoA (derivado do piruvato), pois a reserva alimentar no metabolismo está normal.
- A menor expressão do funcionamento da aconitase não acontece indiretamente pelas enzimas reguladoras do ciclo de Krebs.
- Não há falta de oxigênio no metabolismo celular que possa impedir a reciclagem do NADH e FADH2 e, com isso, diminuir indiretamente a velocidade de funcionamento do ciclo de Krebs.
- A reprogramação celular é suportada pelo metabolismo intracelular e também suportada pelo metabolismo extracelular (que são totalmente interligados, seja de maneira direta ou indireta); ou seja, um é dependente do outro, obedecendo a normas de reações químicas e físicas predefinidas e irreversíveis por muitos anos.
- A reprogramação celular após anos de funcionamento que se torna totalmente irreversível, mas completamente aceita por todo o organismo humano.
- Mas, com o tempo, isso vai gerar consequências que culminarão na parada completa de todo o organismo humano por interferência direta (mas não proposital) no funcionamento dos órgãos.
- Estas observações indicam uma provável função e não disfunção do funcionamento celular, sendo que esta função é de curto prazo e reversível, impedindo a adaptação por mutações genéticas por longo prazo. Pois Isso geraria uma célula diferenciada, mas com características de funcionamento aceitáveis pelo organismo humano.
Mas qual é essa função?
A reprogramação do metabolismo celular é desencadeada por um ataque direto ou indireto à mitocôndria, precisamente no início do seu ciclo. Tal evento compromete indiretamente a produção de ATP (energia), o que prejudica as execuções metabólicas essenciais para a estabilidade e sustentabilidade do funcionamento celular — em outras palavras, sua sobrevivência. Simultaneamente, faz-se necessária a proteção da área afetada e a eliminação do agente agressor, tarefas realizadas pelo metabolismo intrínseco da célula, bem como pelas regulações bioquímicas e pelo sistema imunológico do organismo humano.
Tudo funcionaria perfeitamente, a não ser que…
(A não ser que o agente agressor tenha uma atuação presente de maneira inconstante, variável, mutável, flutuante, irregular e intermitente, mas completamente aceitável pelo metabolismo em um determinado limite de concentração).
Quem é o responsável pelo surgimento do câncer de mama?
O agente agressor apenas inicia o problema (que será revelado em outro post). Mas o principal culpado se chama (tempo), pois é ele que produzirá uma célula totalmente regulada e totalmente sustentável por mutações genéticas adaptativas.
Em Resumo:
A função de proteção da célula, essencial para sua sobrevivência, pode tornar-se uma ameaça mortal para o organismo humano a longo prazo. A célula da mama não tem por objetivo a sua reprodução, mas sim a sua sobrevivência. A sua reprodução descontrolada é uma consequência da sua reprogramação (que será revelado em outro post).
O desenvolvimento inicial do câncer de mama é assintomático (ou seja, ele é imperceptível).
Entendendo a importância do evento iniciador de uma sinalização diferenciada em uma única célula de mama, que dará início a uma reprogramação (reversível) de todo o seu metabolismo, mas que, no futuro, [essa reprogramação] se tornará irreversível, dando origem às células de um tumor primário.
Uma Célula Solitária.
- Origem Unicelular: A maioria dos cânceres, incluindo o de mama, é considerada monoclonal, o que significa que o tumor inteiro descende de uma única célula ancestral que sofreu danos no seu material genético (DNA).
- A Reprogramação definitiva do metabolismo celular é um processo lento, pois ocorre por adaptação, o que terá como consequência alterações nos genes que controlam o ciclo de vida da célula (crescimento, divisão e morte).
Uma Célula diferenciada.
- A célula inicial acumula uma série de mutações por adaptação que desativam os genes supressores de tumor e/ou ativam os oncogenes (genes que promovem o câncer).
- Perda de Controle: Essas alterações fazem com que a célula perca a capacidade de controlar sua própria divisão, resultando em crescimento desordenado e formação de um tumor.
- Tempo de Desenvolvimento: Esse processo de transformação de uma célula normal em um tumor visível é lento e pode levar vários anos, ou até décadas, para se desenvolver completamente.
Em resumo
embora a doença não tenha uma causa única e envolva múltiplos fatores de risco, o início biológico ocorre em uma célula específica que, devido a danos genéticos, começa a se comportar de forma anormal e a se multiplicar descontroladamente.
Obs. (Via DOP) via de descarboxilação do piruvato, que acontece na matriz mitocondrial onde a conversão do piruvato em Acetil-CoA, sendo uma etapa crucial que conecta a glicólise-6-fosfato ao ciclo de Krebs (ou Ciclo do Ácido Cítrico), essencial para a respiração celular aeróbica.
Representação simplificada das interligações entre as vias DOP, ciclo de Krebs e cadeia respiratória (figura 4).
Gostaria de convidá-los a refletir sobre um fato já comprovado.
O que aconteceria se a aconitase fosse atacada e tivesse uma diminuição da sua expressão de funcionamento, fora das regulações normais do ciclo de Krebs, mas de maneira aceitável pelo metabolismo?
Qual é a consequência da diminuição da expressão da aconitase?
Se a atividade da aconitase fosse significativamente reduzida, mesmo que “aceitável pelo sistema” (sugerindo uma inibição parcial ou crônica que permite alguma adaptação), ocorreriam as seguintes consequências bioquímicas:
- Acúmulo de Citrato: A aconitase catalisa a isomerização do citrato em isocitrato. Com a sua atividade reduzida, o citrato (e talvez pequenas quantidades de cis-aconitato, um intermediário temporário) não seria processado eficientemente e se acumularia na matriz mitocondrial.
- Deficiência de Isocitrato e Intermediários a Seguir: A formação de isocitrato e de todos os intermediários subsequentes no ciclo (alfa-cetoglutarato, succinil-CoA, succinato, fumarato, malato e oxaloacetato) seria comprometida.
- Redução da Produção de NADH e FADH₂: O ciclo de Krebs gera a maior parte das coenzimas reduzidas NADH e FADH₂, que são essenciais para a cadeia transportadora de elétrons e a fosforilação oxidativa. A diminuição da atividade do ciclo resultaria em uma produção reduzida dessas moléculas, afetando a geração de ATP.
- Comprometimento da Respiração Celular Aeróbica: A respiração celular aeróbica seria impactada, pois a produção de energia dependeria mais fortemente de outras vias metabólicas, como a glicólise anaeróbica, que é menos eficiente.
- Mecanismos de Compensação: Se a diminuição fosse “aceitável pelo sistema”, a célula ou organismo provavelmente ativariam mecanismos compensatórios. Isso poderia incluir o aumento da glicólise para produzir mais ATP de forma anaeróbica, ou a mobilização de outras fontes de energia (como lipídios e proteínas) para tentar manter as necessidades metabólicas mínimas. A regulação do ciclo de Krebs por disponibilidade de substratos e níveis de ATP e NADH ajudaria a ajustar o metabolismo a essa nova condição.

Representação simplificada do citrato no citosol e a ativação da lipogênese (figura 5).
Qual é a função da aconitase no ciclo de Krebs?
A aconitase é uma enzima sensível que contém um aglomerado de ferro-enxofre (4fe-4s) em seu sítio ativo, com a função de catalisa a isomerização reversível do citrato em isocitrato e, embora seja uma enzima crucial no funcionamento do ciclo Krebs, ela não é um ponto primário de regulação alostéric do fluxo metabólico. A regulação principal do ciclo é exercida por outras enzimas-chave, que influenciam indiretamente no seu funcionamento:
- Citrato sintase: Inibida por ATP, NADH e succinil-CoA.
- Isocitrato desidrogenase: Ativada por ADP e Ca²⁺, e inibida por ATP e NADH.
- Alfa-cetoglutarato desidrogenase: Inibida por NADH e succinil-CoA, e ativada por Ca²⁺. A atividade da aconitase pode ser afetada por fatores indiretos, como o acúmulo de seu substrato (citrato) ou produto (isocitrato) devido à inibição das enzimas reguladoras a montante ou a jusante, ou por dano oxidativo (inativação reversível por superóxido), mas ela própria não é um alvo direto das principais enzimas reguladoras do ciclo. O controle do fluxo metabólico do ciclo é primariamente ajustado por meio da modulação das três enzimas mencionadas acima, em resposta às necessidades energéticas e ao estado redox da célula (indicado pelas concentrações de ATP, ADP, NADH e NAD⁺).
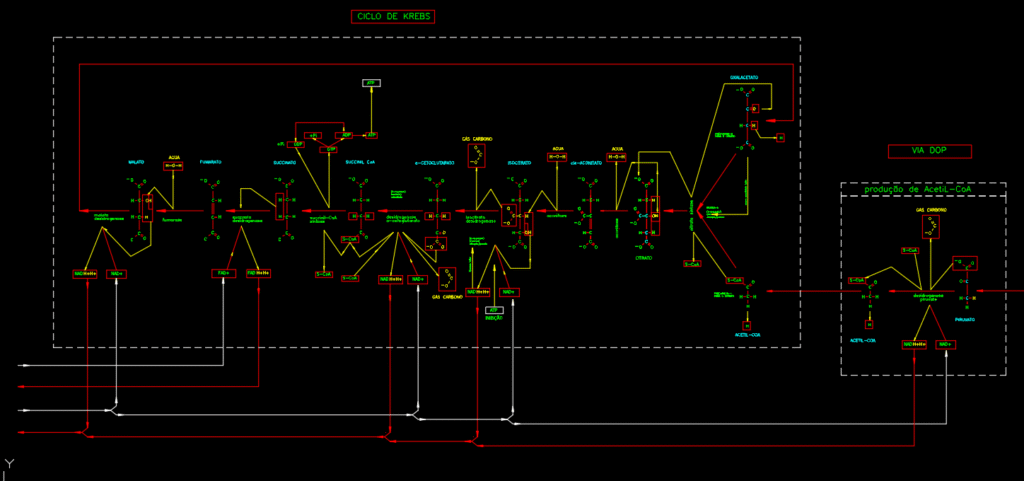
Representação simplificada do funcionamneto do ciclo de Krebs (figura 6).
A baixa expressão da enzima aconitase provoca o acúmulo de citrato na matriz mitocondrial.
Como a aconitase é a segunda enzima do ciclo do ácido cítrico (Ciclo de Krebs), responsável por catalisar a isomerização do citrato em isocitrato. Quando a atividade dessa enzima é reduzida, a conversão do citrato é prejudicada, fazendo com que ele se acumule dentro da mitocôndria e subsequentemente, possa ser liberado para o citoplasma ou meio extracelular.
A concentração elevada de citrato na mitocôndria ativa o seu transportador de exportação.
Especificamente o transportador mitocondrial de citrato (também conhecido como citrate carrier – CIC ou proteína SLC25A1 em humanos), permitindo sua saída para o citosol. A exportação de citrato ocorre por um mecanismo de antiporte 1:1, no qual o malato é transportado do citosol para a mitocôndria em troca do citrato que sai. Esse ciclo é conhecido como lançadeira citrato-malato.
As consequências da adaptação da estabilidade da aconitase a uma menor velocidade de atuação no ciclo de Krebs:
- Efeito na Aconitase: Embora a aconitase em si não seja o alvo direto da inibição neste cenário, o acúmulo de seu produto (isocitrato) e substrato (citrato) pode levar a uma diminuição da sua atividade líquida (inibição pelo produto ou por acúmulo de substrato) devido à termodinâmica da reação reversível ou mecanismos alostéricos de regulação. Além disso, altos níveis de citrato podem atuar como inibidores alostéricos de enzimas anteriores, como a fosfofrutoquinase-1 na glicólise.
- Tudo está funcionando “normal”: a diminuição da expressão de funcionamento da aconitase e um acontecimento normal quando a concentração de ATP, NADH e FADH2 são altas, provocando o desvio do citrato da mitocôndria para o citosol, dando início a lipogênese, isso acontece todo dia no estágio de jejum do organismo.
Diminuição da produção de parte do NADH e FADH2 gerados nas etapas subsequentes do ciclo krebs.
A aconitase catalisa a conversão do citrato em isocitrato no início do ciclo de Krebs. Se essa etapa estiver pouco expressa produzirá feitos diferenciados:
- Todas as reações seguintes ocorrerão em baixa velocidade.
- O primeiro NADH do ciclo (formado na conversão de isocitrato em alfa-cetoglutarato) será produzido com pouca expressão.
- O segundo e o terceiro NADH (formados na conversão de alfa-cetoglutarato em succinil-CoA e na conversão de malato em oxaloacetato, respectivamente) também serão produzidos com pouca expressão.
- O único FADH2 do ciclo (formado na conversão de succinato em fumarato) também será produzido com pouca expressão.
- Portanto, a baixa expressão de funcionamento da aconitase, diminuirá a velocidade da sequência de reações oxidativas, que levam à formação dessas coenzimas reduzidas, essenciais para a cadeia de transporte de elétrons e a síntese de ATP.
Com a baixa produção de NADH e FADH₂ no ciclo de Krebs, a uma interferência diretamente na cadeia respiratória.
Estas moléculas são cruciais para o seu funcionamento. Os dois processos são interativos e interdependente um do outro (mais não-linear), mas formam relação cíclica de acoplamento, apesar de parecer uma sequência direta, o funcionamento não é uma linha reta, porque a cadeia respiratória possui mais de uma via de fornecimento de moleculas de NADH e FADH₂, que também podem ser produzidos pela β-oxidação.
Em resumo:
- O ciclo de Krebs só continua se houver NAD⁺ e FAD disponíveis, que vêm da oxidação na cadeia respiratória.
- A cadeia respiratória só funciona se receber NADH e FADH₂ do ciclo de Krebs (e da glicólise/β-oxidação).
- Cadeia Respiratória ou β-oxidação → oxida NADH/FADH₂ → regenera NAD⁺ e FAD → para o Ciclo de Krebs ou β-oxidação continuar. Ou seja, um alimenta e recicla o outro.
- Se um diminui, o outro reduz a atividade também.
Obs. Por enquanto, vamos analisar especificamente a relação, entre o Ciclo de Krebs e a Cadeia Respiratória, deixando posteriormente para analisar a relação, entre β-oxidação e a Cadeia Respiratória.
As consequências de pouca produtividade de NADH e FADH₂ no ciclo de Krebs, para a cadeia respiratória:
- Falta de elétrons: com pouco fornecimento contínuo de NADH e FADH₂, haverá poucos elétrons para fluir através dos complexos da cadeia respiratória.
- Com baixo bombeamento de prótons: O movimento dos elétrons pela cadeia libera energia que é utilizada para bombear íons H⁺ (prótons) da matriz mitocondrial para o espaço Inter membrana. Com um menor transporte de elétrons a velocidade desse bombeamento diminuí.
- Colapso do gradiente eletroquímico: com uma menor expressão desses gradientes de prótons (diferença de concentração e carga elétrica) diminui o funcionamento da ATP sintase, a enzima responsável pela produção da maioria do ATP celular (fosforilação oxidativa).
- baixa produção de ATP: Como resultado, a síntese de ATP é drasticamente reduzida, levando a célula a um estado de deficiência energética abaixo do normal
Consequência geral:
O principal objetivo do ciclo de Krebs não é produzir ATP diretamente, mas gerar NADH e FADH₂, que são transportadores de elétrons de alta energia para os complexos proteicos localizados na membrana mitocondrial interna, que compõem a cadeia de transporte de elétrons (cadeia respiratória), mais se a cadeia não recebe “combustível” suficiente a produção de ATP despenca, afetando todo o funcionamento bioquímico da célula, devido sua demanda energética.
O detalhamento da reprogramação da célula da mama, que vai dar origem ao câncer de mama, (iniciará no próximo post).
Referências:
Prof. Dorival filho
- Ciclo de Krebs (para ensino superior) https://www.youtube.com/watch?v=R_K7w9RyC5M&t=1s
- Cadeia Respiratória (para o ensino superior) https://www.youtube.com/watch?v=K6Nkcq2aiUU&t=49s
- Síntese de ácidos graxos. https://www.youtube.com/watch?v=8S5wQvwCj_8&t=2s
Aconitase no câncer de mama
https://en.wikipedia.org/wiki/Aconitase
https://en.wikipedia.org/wiki/ACO2
https://pubmed.ncbi.nlm.nih.gov/31819175
https://www.sciencedirect.com/topics/medicine-and-dentistry/aconitase
Citrato no câncer de mama
https://pmc.ncbi.nlm.nih.gov/articles/PMC8235534
https://onlinelibrary.wiley.com/doi/10.1002/mco2.27
https://www.ijbs.com/v19p0897.htm
https://repositorio.unb.br/bitstream/10482/22156/1/2016_JoseilmaLucianaNevesSiqueira
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2018.00141/full
https://spj.science.org/doi/10.34133/research.0351
Llipogênese no câncer de mama
https://pt.wikipedia.org/wiki/Lipog%C3%AAnese
https://www.mdpi.com/2072-6694/15/8/2195