Breast Cancer: Predominance of AMPK Signaling over Insulin in the Regulation of GLUT1
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 13/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
No câncer de mama, a glicose constitui o eixo central da sobrevivência celular, integrando sinalização metabólica, adaptação energética e progressão tumoral. Nesse contexto, a AMPK e a insulina atuam como reguladores complementares da captação e utilização da glicose, modulando a sustentação glicolítica e a viabilidade da célula cancerígena mamária. Embora sejam tradicionalmente descritas como vias funcionalmente opostas, na célula tumoral essas sinalizações coexistem e são exploradas de forma integrada.
A insulina promove a entrada de glicose e ativa programas anabólicos que sustentam a alta demanda energética e biossintética do tumor. Em paralelo, a AMPK atua como sendo um sensor de estresse metabólico, preservando o equilíbrio mínimo de ATP e garantindo a continuidade da glicólise mesmo diante de disfunções mitocondriais, hipóxia ou baixa eficiência do ciclo de Krebs. Essa atuação da AMPK não representa apenas um mecanismo de contenção energética, mas tambem é um sistema de ajuste fino, que viabiliza a sobrevivência celular em condições adversas.
Inicialmente, a cooperação funcional entre AMPK e insulina (comprovado cientificamente) exerce um papel protetor, limitando o colapso energético e permitindo a adaptação metabólica. Entretanto, no contexto da reprogramação do metabolismo quando é mantida de forma crônica, essa dinâmica sempre vai favorecer uma reprogramação metabólica estável, acompanhada de instabilidade genômica e perda irreversível da identidade da célula mamária. Assim, a glicose, sob regulação conjunta da AMPK e da insulina, deixa de ser apenas um substrato energético e passará a constituir um elemento estrutural da biologia do câncer de mama.
Palavras-chave: Câncer-de-mama, reprogramação-do-metabolismo-celular, GLUT1, AMPK, insulina
Abstract
In breast cancer, glucose constitutes the central axis of cellular survival, integrating metabolic signaling, energetic adaptation, and tumor progression. In this context, AMPK and insulin act as complementary regulators of glucose uptake and utilization, modulating glycolytic support and the viability of the breast cancer cell. Although they are traditionally described as functionally opposing pathways, in tumor cells these signaling routes coexist and are exploited in an integrated manner.
Insulin promotes glucose entry and activates anabolic programs that sustain the high energetic and biosynthetic demands of the tumor. In parallel, AMPK acts as a sensor of metabolic stress, preserving minimal ATP balance and ensuring the continuity of glycolysis even in the presence of mitochondrial dysfunction, hypoxia, or low efficiency of the Krebs cycle. This action of AMPK does not represent merely an energy-constraining mechanism, but also a fine-tuning system that enables cellular survival under adverse conditions.
Initially, the functional cooperation between AMPK and insulin (scientifically demonstrated) plays a protective role, limiting energetic collapse and allowing metabolic adaptation. However, in the context of metabolic reprogramming, when maintained chronically, this dynamic invariably favors a stable metabolic reprogramming state, accompanied by genomic instability and irreversible loss of mammary cell identity. Thus, glucose, under the joint regulation of AMPK and insulin, ceases to be merely an energy substrate and becomes a structural element of breast cancer biology.
Keywords: Breast cancer; cellular metabolic reprogramming; GLUT1; AMPK; insulin.
Introdução
Na célula mamária cancerígena, o controle do metabolismo energético deixa de obedecer à lógica da especialização tecidual e passa a ser regido por mecanismos de sobrevivência. Nesse contexto, a AMPK (proteína quinase ativada por AMP) e a insulina ocupam posições centrais e complementares na regulação da entrada de glicose, isso é essencial para que haja uma sustentação glicolítica e da adaptação metabólica tumoral. Embora os dois processos sejam tradicionalmente descritos como vias antagônicas. Onde a AMPK é associada ao déficit energético e a insulina a um estado de abundância energética, na célula tumoral mamária essas sinalizações coexistem e são funcionalmente integradas (como tudo no metabolismo é).
A insulina atua como potente estímulo para a captação de glicose e ativação de vias anabólicas, favorecendo crescimento, proliferação e manutenção da demanda energética elevada típica do tumor. Paralelamente, nesse contexto a AMPK se mantém ativada como sensor de estresse metabólico, garantindo a preservação do equilíbrio mínimo de ATP, mesmo diante de disfunções mitocondriais, hipóxia ou da ineficiência do ciclo de Krebs.
Obs. Essa ativação não representa que exista um freio absoluto para o crescimento, mas sim que haja um mecanismo de ajuste fino, que vai permitir que à célula cancerígena possa sustentar sua viabilidade em condições adversas (ou seja. Essa regulação é flutuante).
Na célula mamária tumoral, a interação entre AMPK e insulina não configura um conflito funcional, mas um sistema adaptativo no qual sinais de abundância e escassez energética são explorados simultaneamente, já fazendo parte de uma reprogramação pré-definida (como uma função). Inicialmente, esse arranjo vai desempenha um papel protetor, limitando danos celulares e prevenindo colapsos energéticos. Contudo, quando ele é mantido de forma crônica, estabelece uma reprogramação metabólica estável, favorecendo por consequência, uma perda irreversível da identidade celular, o acúmulo de mutações genéticas e a consolidação do fenótipo maligno.
Dessa forma, compreender o papel integrado da AMPK e da insulina na célula cancerígena mamária é essencial para interpretar o metabolismo tumoral não apenas como consequência do câncer, mas como um dos seus principais motores biológicos. Para isso, não devemos apenas entender o funcionamento de cada processo, mais também quem influencia cada processo paralelamente.
GLUT1, GLUT2, GLUT3 e GLUT4
O potencial e a regulação da entrada de glicose não são iguais entre os transportadores da celula de mama GLUT1, GLUT2, GLUT3 e GLUT4. Eles diferem significativamente em sua afinidade pela glicose (determinado pelo valor de Km), localização tecidual e mecanismo de regulação, o que reflete seus papéis fisiológicos distintos no corpo.
Na célula mamária normal. A captação de glicose é rigidamente controlada para atender às demandas metabólicas do tecido sem comprometer sua identidade funcional.
O GLUT1 exerce um papel basal, garantindo um suprimento contínuo e estável de glicose suficiente para a manutenção energética celular, sem induzir fluxos excessivos ou desregulados.
O GLUT2 não possui relevância funcional significativa na célula mamária, pois sua baixa afinidade pela glicose e função predominantemente sensorial estão associadas ao fígado e ao pâncreas, não participando do controle metabólico direto do epitélio mamário.
O GLUT3 apresenta expressão mínima ou ausente em condições fisiológicas, uma vez que sua alta afinidade pela glicose é característica de tecidos com demanda energética crítica e contínua, como neurônios e placenta, não sendo necessária em um tecido mamário diferenciado.
O GLUT4, por sua vez, pode estar presente de forma discreta na célula mamária normal, mas sua atuação é secundária e dependente de insulina, contribuindo apenas de maneira complementar para a captação de glicose em estados hormonais específicos.
Na célula mamária tumoral, especialmente em contextos de alta agressividade, ocorre uma reorganização profunda desse sistema.
O GLUT1 torna-se o principal eixo de captação glicídica, tendo uma superexpressão de forma constitutiva para garantir um fluxo contínuo e independente de insulina, sustentando a sobrevivência celular frente à disfunção mitocondrial e ao estresse metabólico.
O GLUT2 permanece funcionalmente irrelevante no câncer de mama, pois sua cinética não favorece a captação eficiente em ambientes de baixa disponibilidade de glicose.
O GLUT3 passa a ser induzido em estágios mais avançados ou agressivos, como no câncer de mama triplo-negativo, conferindo à célula tumoral uma vantagem adaptativa crítica ao permitir captação eficiente de glicose mesmo em microambientes extremamente pobres em nutrientes, favorecendo invasão, plasticidade celular e progressão metastática.
O GLUT4 torna-se funcionalmente eclipsado no contexto tumoral, uma vez que a dependência de insulina é incompatível com a necessidade de captação energética contínua e autônoma da célula cancerígena.
Tabela dos transportadores de glicose, na célula mamária normal
| Característica | GLUT1 | GLUT2 | GLUT3 | GLUT4 |
| Afinidade pela glicose (Km) | Alta afinidade (baixo Km, ~1 mM), adequada para captação basal estável | Baixa afinidade (alto Km, ~15–20 mM), ineficiente em níveis fisiológicos locais | Afinidade muito alta (Km muito baixo, ~0,5–1 mM), porém geralmente não requerida | Alta afinidade (baixo Km, ≤ 5 mM) |
| Regulação pela insulina | Independente | Independente | Independente | Dependente |
| Expressão na célula mamária normal | Presente de forma constitutiva e moderada | Ausente ou funcionalmente irrelevante | Muito baixa ou ausente | Baixa a discreta, dependente do estado hormonal |
| Função fisiológica no epitélio mamário | Manutenção do metabolismo basal e da homeostase energética celular | Não exerce função metabólica relevante no tecido mamário | Não participa da captação glicídica fisiológica do epitélio mamário | Contribuição secundária e regulada para captação de glicose em estados hormonais específicos |
| Relação com diferenciação tecidual | Compatível com a identidade funcional da célula mamária diferenciada | Não relacionada à diferenciação mamária | Incompatível com o estado diferenciado normal | Associado a respostas metabólicas hormonais, sem romper a identidade celular |
| Papel na homeostase energética | Garante fluxo glicídico estável sem induzir estresse metabólico | Não contribui para a homeostase energética local | Desnecessário em condições fisiológicas normais | Complementar e transitório |
| Relevância fisiológica | Essencial para manutenção celular | Irrelevante | Irrelevante | Secundária |
Tabela dos transportadores de glicose, na célula mamária tumoral
| Característica | GLUT1 | GLUT2 | GLUT3 | GLUT4 |
| Afinidade pela glicose (Km) | Alta afinidade (baixo Km, ~1 mM), favorece fluxo contínuo | Baixa afinidade (alto Km, ~15–20 mM), ineficiente em microambiente tumoral | Afinidade extremamente alta (Km ~0,5–1 mM), captação eficiente em escassez extrema | Alta afinidade (≤ 5 mM), porém dependente de sinal hormonal |
| Regulação pela insulina | Independente | Independente | Independente | Dependente (funcionalmente perdida no tumor) |
| Expressão na célula mamária tumoral | Superexpressão constitutiva | Ausente ou irrelevante | Induzido em tumores agressivos e triplo-negativos | Presente, porém funcionalmente eclipsado |
| Eixo regulador dominante | AMPK, HIF-1α, NF-κB, c-Myc | Não integrado ao metabolismo tumoral | AMPK, HIF-1α/HIF-2α, EMT, estresse energético severo | Via insulina–PI3K frequentemente dissociada |
| Função metabólica principal | Garantir suprimento basal contínuo de glicose para sobrevivência | Sem papel adaptativo relevante | Garantir captação de glicose em ambientes de extrema limitação energética | Não sustenta captação contínua |
| Relação com a mitocôndria ineficiente | Compensa baixa eficiência oxidativa por aumento de fluxo | Não compensa falha mitocondrial | Permite sobrevivência quando GLUT1 se torna insuficiente | Incompatível com disfunção mitocondrial |
| Impacto no pH e microambiente | Sustenta glicólise e acidificação progressiva | Irrelevante | Intensifica acidotolerância e invasão | Sem impacto adaptativo |
| Associação com agressividade tumoral | Essencial para manutenção do tumor | Nenhuma | Fortemente associada a invasão, EMT e metástase | Nenhuma |
| Compatibilidade com diferenciação celular | Incompatível com estado diferenciado | — | Altamente incompatível | Parcialmente compatível, porém inoperante |
| Papel na progressão tumoral | Eixo metabólico estrutural | — | Eixo adaptativo tardio e de agressividade máxima | Eclipsado |
O que já é comprovado no meio científico através de estudos, da Regulação transcricional epigenética e pós-traducional de GLUT1 e GLUT3 no câncer de mama
Os mecanismos de nova regulação de GLUT1 e GLUT3 no câncer de mama envolvem múltiplos níveis de controle transcricional, pós-transcricional, epigenético e pós-traducional, refletindo uma complexidade da reprogramação metabólica tumoral. Diferentes componentes já descritos na literatura atuam como reguladores positivos ou negativos desses transportadores, modulando a sua expressão e funcionalidade de acordo com o estado metabólico e o microambiente tumoral.
Para o GLUT1, é amplamente validado como o principal transportador de glicose no câncer de mama, a sua regulação ocorre predominantemente no nível transcricional. Fatores de transcrição como HIF-1α, c-Myc, SIX1 e, em contextos específicos, a perda funcional de p53, promovem a indução do gene SLC2A1, especialmente quando em condições de hipóxia, pseudohipóxia metabólica e alta demanda energética. O deu regulador metabólico TXNIP, reconhecido como um inibidor fisiológico do GLUT1, encontra-se frequentemente totalmente suprimido em tumores mamários, removendo um importante freio negativo para a captação de glicose. Além disso, modificadores de cromatina como o HDAC2 também participam da remodelação epigenética do locus SLC2A1, aumentando para uma acessibilidade transcricional e consolidando a sua superexpressão. No nível pós-transcricional, o SLC2A1 é alvo de microRNAs, incluindo miR-132, miR-144 e miR-150, cuja redução funcional em tumores mamários contribui para aja a estabilização do mRNA e aumento da expressão proteica.
No nível pós-traducional, o GLUT1 é regulado por um mecanismo que controlam sua estabilidade e localização na membrana plasmática. Devido a perda ou inativação de PTEN, frequente no câncer de mama, isso resulta em hiperativação da via PI3K/AKT, favorecendo a retenção do GLUT1 na membrana e reduzindo sua degradação. Proteínas envolvidas no controle da qualidade proteica, como DERL3, assim como fatores associados à angiogênese e adaptação metabólica, incluindo VEGF e PON2, também contribuem para a manutenção funcional do GLUT1 em células tumorais mamárias.
A regulação do GLUT3, embora menos universal, é particularmente relevante em subtipos mais agressivos do câncer de mama, como o triplo-negativo. A sua expressão é controlada principalmente por mecanismos transcricionais que são associados a estresse metabólico severo, como inflamação e transição epitélio-mesênquimal. Fatores como NF-κB e HIF-1α foram descritos em estudos, como indutores diretos da transcrição do SLC2A3 em contextos tumorais, incluindo em câncer de mama muito agressivo. Reguladores da arquitetura cromatínica e da plasticidade celular, como HMGA1 e ZBTB7A, também participam da ativação do promotor ou de regiões regulatórias iniciais do gene. Já no nível pós-transcricional, a redução de microRNAs como miR-195-5p, são descritas em câncer de mama, contribui para aja uma estabilização do mRNA do GLUT3 com o aumento de sua tradução.
Em estudos, é relado que adicionalmente, um elemento intensificador localizado no segundo íntron do gene SLC2A3 demonstra alta responsividade a fatores de transcrição associados à EMT e à agressividade tumoral, como ZEB1 e o complexo TCF4/β-catenina, ambos são bem documentados no câncer de mama triplo-negativo. Esse mecanismo reforça a expressão sustentada do GLUT3 em contextos de invasão, hipoxia intermitente e escassez extrema de glicose no metabolismo.
Já no nível proteico, embora a dinâmica de retenção citoplasmática e translocação do GLUT3 tenha sido inicialmente caracterizada em leucócitos e outros tipos celulares, a evidências em câncer de mama que indicam que mecanismos semelhantes de controle de tráfego podem ocorrer, especialmente em células altamente plásticas, contribuindo para a rápida adaptação metabólica em nichos invasivos.
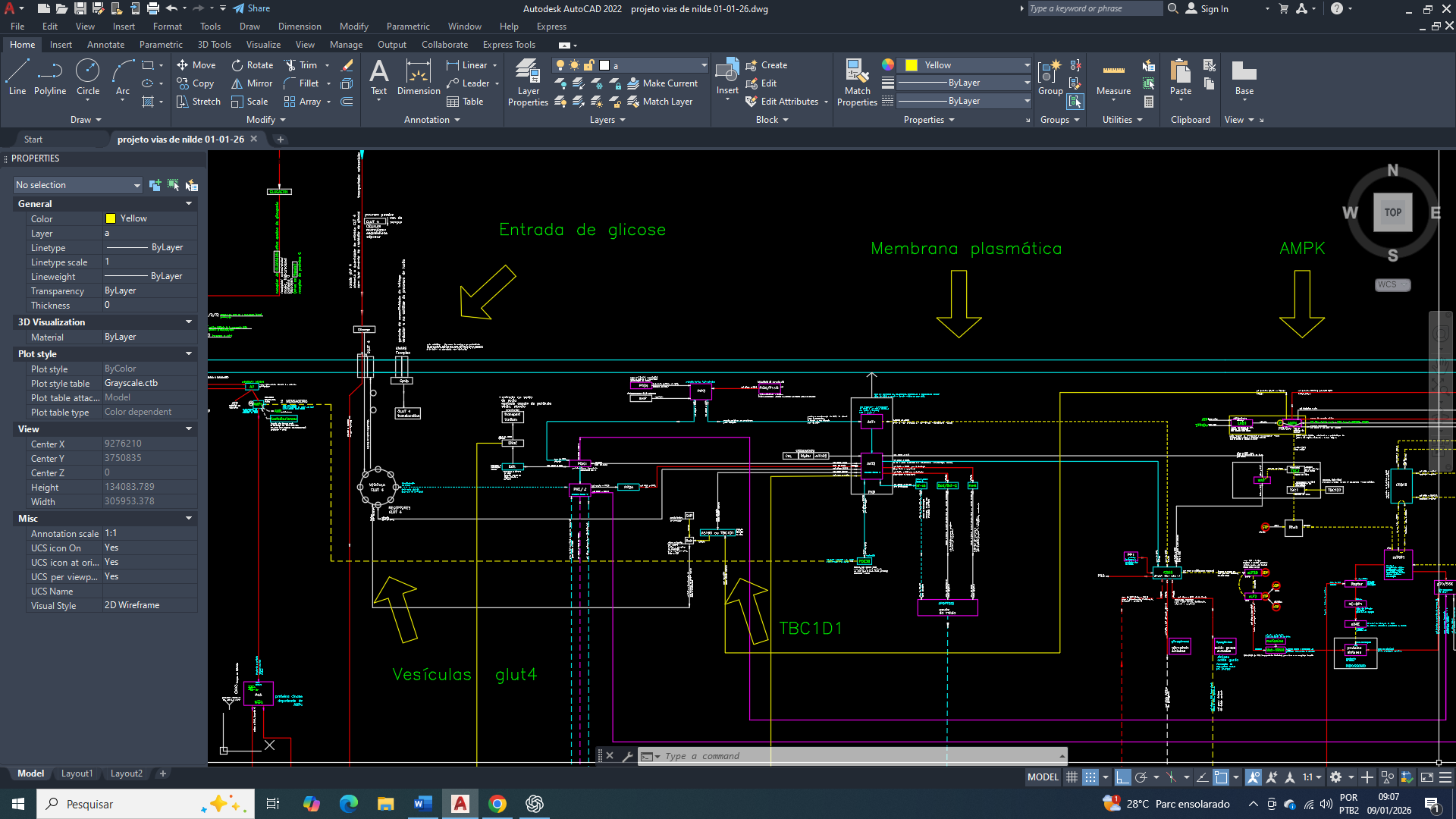
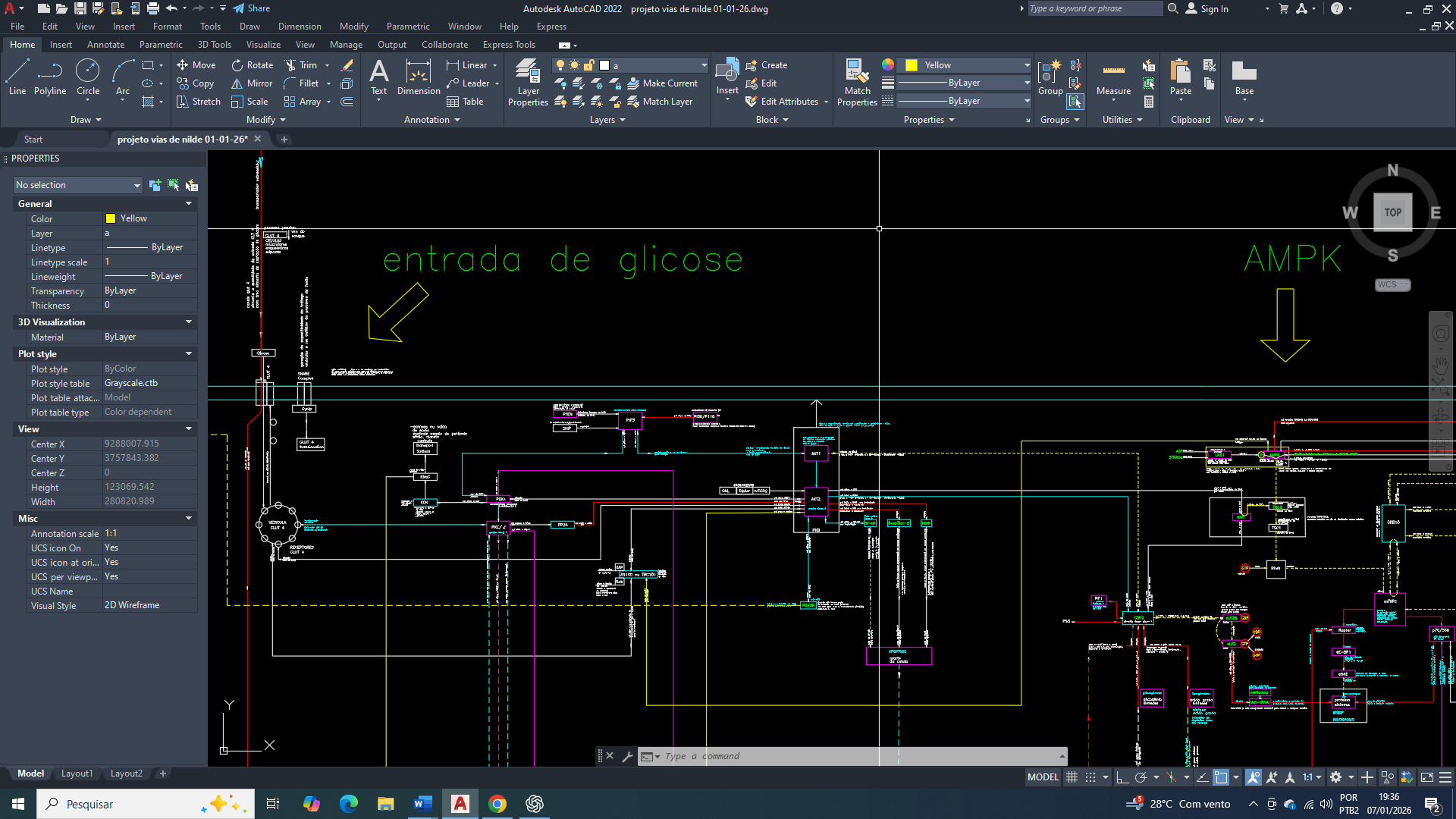
Neste post, vamos nos concentrar na importância do GLUT1 (Glucose Transporter 1) na célula mamária tumoral
O GLUT1 funciona como o eixo metabólico basal na célula mamária, atuando não como indutor direto de crescimento, mas como elemento de sustentação energética. Em condições fisiológicas, sua função é assegurar a disponibilidade mínima de glicose necessária à manutenção celular, respeitando os limites impostos pelo estado energético global e pela regulação da AMPK, contribuindo para a preservação da estabilidade funcional e genética do tecido mamário.
No câncer de mama, já e comprovado que o GLUT1 (SLC2A1) torna-se o transportador central e dominante da captação de glicose, atuando de forma independente da insulina e garantindo um fornecimento contínuo de glicose suficiente para a sobrevivência celular e para a proliferação basal. Sua alta afinidade pela glicose (baixo Km) permite uma manutenção do metabolismo glicolítico mesmo em condições de oferta limitada, típicas do microambiente tumoral. A ativação da AMPK em resposta ao estresse energético, associada à estabilização do HIF-1α em ambientes hipóxicos, converge para o aumento da expressão e da atividade funcional do GLUT1, sustentando o efeito Warburg, o equilíbrio redox e a produção dos intermediários metabólicos que são essenciais à biossíntese básica.
Entretanto devemos levar em consideração, que em contextos de estresse energético profundo e prolongado, nos quais a disponibilidade de glicose extracelular se torna criticamente baixa e a demanda metabólica ultrapassa a capacidade de compensação do GLUT1, e a sua afinidade funcional deixa de ser suficiente para sustentar uma proliferação tumoral agressiva e contínua. Nessa fase, o GLUT3 passa a ser necessário como mecanismo adaptativo complementar, oferecendo captação de glicose de altíssima eficiência e garantindo a sobrevivência celular em condições extremas. Assim, no câncer de mama, o GLUT1 assegura a base energética mínima, enquanto o GLUT3 viabiliza a progressão tumoral sob colapso metabólico, caracterizando uma cooperação funcional e não uma atuação isolada.
Integração do GLUT1 (Glucose Transporter 1) com o AMPK
Em células mamárias tumorais, a ativação persistente da AMPK, em resposta ao estresse energético, associada à uma estabilização continua do HIF-1α, converge para a indução transcricional e a manutenção funcional do GLUT1 na membrana plasmática, sustentando o efeito Warburg. Esse arranjo metabólico vai assegurar a homeostase redox, a regeneração de NADPH e o fornecimento de precursores metabólicos indispensáveis para manter à biossíntese de macromoléculas, à adaptação metabólica e à sobrevivência tumoral.
A AMPK atua como o eixo inicial da adaptação metabólica e de garantir a preservação do GLUT1 (Glucose Transporter 1), para manutenção contínua da produção energética
Quando a célula está com baixos níveis de energia (alta proporção AMP/ATP), a AMPK é ativada. A AMPK vai fosforila a TXNIP, o que leva à rápida degradação da TXNIP, que tem a função de remover o glut1 da membrana, essa degradação vai resultar em um aumento agudo da função do GLUT1 na superfície da célula, aumentando a captação de glicose. A consequência do efeito agudo da redução da TXNIP pela AMPK também vai levar a longo prazo, a um aumento nos níveis de RNA mensageiro (mRNA) do GLUT1, o que eleva a quantidade total de proteína GLUT1 na célula. (Levando a uma adaptação genética a longo prazo, a uma alta expressão do glut1 permanente).
O papel do GLUT1 (Glucose Transporter 1) no funcionamento do metabolismo do câncer de mama
No câncer de mama, a reprogramação metabólica emerge a partir de alterações iniciais no funcionamento mitocondrial, nas quais a aconitase mitocondrial (ACO2), enzima dependente do cluster [4Fe–4S], atua como um ponto crítico de sensibilidade redox, energética e termodinâmica, sendo particularmente vulnerável ao aumento de espécies reativas de oxigênio (ROS) e às flutuações do potencial redox mitocondrial. A oxidação parcial ou a perda funcional do cluster ferro-enxofre da aconitase não resulta em um colapso completo do ciclo do ácido tricarboxílico, mas em uma desaceleração seletiva da conversão de citrato em isocitrato, promovendo acúmulo de citrato e redirecionamento metabólico para vias anabólicas, como lipogênese, ao mesmo tempo em que reduz a eficiência global da fosforilação oxidativa. Do ponto de vista termodinâmico, essa alteração desloca o sistema mitocondrial para um estado de menor rendimento energético por molécula de substrato oxidado, elevando a dissipação de energia sob a forma de calor e aumentando a entropia metabólica intracelular, o que compromete a manutenção de gradientes eletroquímicos ideais na membrana mitocondrial interna. A queda relativa no rendimento de ATP por NADH/FADH₂ altera a razão ATP/ADP/AMP, favorecendo o aumento sustentado de AMP e a ativação crônica da AMPK, que deixa de atuar como um sensor transitório de estresse energético e passa a integrar um programa adaptativo de sobrevivência celular tumoral.
Paralelamente, a disfunção da aconitase mitocondrial e o aumento do estresse oxidativo promovem a conversão funcional da aconitase citosólica em proteína reguladora do ferro (IRP1), a qual se liga a elementos responsivos ao ferro (IREs) em mRNAs específicos, modulando indiretamente a tradução de proteínas envolvidas no metabolismo energético, na homeostase mitocondrial e na resposta ao estresse, reforçando um estado celular metabolicamente instável, porém adaptável. A limitação relativa da fosforilação oxidativa impõe à célula mamária tumoral uma dependência crescente da glicólise-6-fosfato como fonte primária de ATP, não apenas pela sua velocidade, mas pela sua previsibilidade termodinâmica em ambientes onde o gradiente mitocondrial e o pH intracelular encontram-se alterados. A intensificação da glicólise leva ao aumento da produção de lactato e prótons, promovendo acidificação do microambiente extracelular e exigindo mecanismos ativos de tamponamento intracelular, como a ativação de transportadores monocarboxilatos (MCT1/MCT4), trocadores Na⁺/H⁺ (NHE1) e anidrases carbônicas associadas à membrana, especialmente CAIX, cuja expressão é fortemente regulada por HIF-1α.
Do ponto de vista físico-químico, a redução do pH extracelular e a manutenção de um pH intracelular relativamente alcalino favorecem a progressão tumoral ao alterar a conformação de proteínas, a afinidade enzima-substrato e a direção efetiva de reações metabólicas, deslocando equilíbrios termodinâmicos em favor de vias glicolíticas e biossintéticas. A acidificação também compromete a integridade do estroma, facilita invasão tecidual e seleciona clones celulares mais tolerantes a ambientes hostis. Nesse cenário, a estabilização de HIF-1α ocorre não apenas por hipóxia clássica, mas por pseudohipóxia metabólica, decorrente do acúmulo de metabólitos do ciclo de Krebs, alterações no estado redox mitocondrial e inibição funcional de prolil-hidroxilases dependentes de α-cetoglutarato. O HIF-1α atua em sinergia com fatores como c-Myc, NF-κB, ATF4 e Sp1, integrando sinais energéticos, redox e inflamatórios, culminando na ativação transcricional sustentada do gene SLC2A1, responsável pela expressão do transportador GLUT1.
A superexpressão do GLUT1 estabelece, assim, um eixo metabólico dominante que garante captação contínua e não regulada de glicose, independentemente de insulina ou da função fisiológica original da célula mamária. Esse influxo glicídico elevado não apenas sustenta a produção rápida de ATP via glicólise-6-fosfato, mas alimenta vias paralelas fundamentais para a adaptação tumoral, como a via das pentoses fosfato, responsável pela geração de NADPH, essencial para o controle redox, regeneração de glutationa reduzida e tolerância ao estresse oxidativo crônico. O aumento do NADPH não elimina o dano oxidativo, mas permite que a célula sobreviva em um estado de dano molecular persistente, favorecendo o acúmulo progressivo de mutações, instabilidade genômica e heterogeneidade clonal. Simultaneamente, a ativação contínua de vias como PI3K/AKT/mTOR, reforçada pelo estado energético permissivo, promove síntese proteica, crescimento celular e bloqueio de vias pró-apoptóticas, consolidando um fenótipo altamente plástico e resistente.
Funcionalmente, esse programa metabólico sustentado pelo GLUT1 impõe uma reorganização completa da hierarquia celular, na qual a manutenção da identidade funcional da célula mamária diferenciada torna-se termodinamicamente desfavorável frente às exigências de sobrevivência e proliferação. A diferenciação tecidual, que demanda controle fino do metabolismo, estabilidade redox e baixo ruído energético, é progressivamente abandonada em favor de um estado celular desdiferenciado, energeticamente permissivo, acidotolerante e metabolicamente flexível. Assim, no câncer de mama, a superexpressão do GLUT1 não representa apenas um marcador metabólico, mas o resultado de uma cadeia integrada de eventos que envolve disfunção mitocondrial parcial, colapso da eficiência termodinâmica, adaptação ao estresse redox, reorganização do pH intra e extracelular e reprogramação transcricional profunda, culminando na perda irreversível da identidade funcional da célula mamária e na progressão tumoral agressiva.
conclusão
No câncer de mama, a superexpressão do GLUT1 promove captação elevada e contínua de glicose, sustentando a ativação crônica de vias de sobrevivência celular e adaptação metabólica. Esse fluxo glicídico persistente contribui para a reprogramação metabólica, o desequilíbrio redox e a tolerância ao estresse oxidativo, favorecendo a instabilidade genômica e a progressão tumoral, em vez de preveni-las, garante energia ilimitada para muitas mutações genéticas por adaptações. Nesse contexto de funcionamento metabólico, o GLUT1 produz um conjunto facilitador metabólico da desdiferenciação, contribuindo para a perda da identidade funcional da célula mamária ao sustentar um programa energético incompatível com a função tecidual especializada. Pois a reprogramação do metabolismo tem por objetivo favorece sobrevivência e proliferação em detrimento da diferenciação tecidual.
Deus o pai deixa claro que em dificuldades a união de todos é imprescindível
(Um homem sozinho pode ser vencido, mas dois conseguem defender-se. Um cordão de três dobras não se rompe com facilidade) (Eclesiastes 4:12)
Alvo terapêutico no transportador de glicose 1 (GLUT1) no câncer: mecanismos moleculares e aplicações em nanomedicina.
Valor prognóstico da proteína transportadora de glicose-1 (GLUT1) no carcinoma de mama
https://www.tandfonline.com/doi/full/10.1080/19932820.2023.2283953#d1e750
Expressão do gene GLUT1 nas linhagens celulares de câncer de mama MCF-7 e MDA-MB-231.
https://europepmc.org/article/med/14674124
A modulação dos níveis de expressão do transportador de glicose 1 (GLUT1) altera o crescimento de células tumorais mamárias de camundongos in vitro e in vivo.
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0023205
Significado patológico da expressão de GLUT-1 em células de câncer de mama em pacientes diabéticas e obesas: o estudo da Guiana Francesa.
https://www.mdpi.com/2072-6694/14/2/437
Transportadores de glicose no câncer – das células tumorais ao microambiente tumoral
https://febs.onlinelibrary.wiley.com/doi/10.1111/febs.14577