Breast Cancer: Consolidation of ATP Production Restoration in Cellular Metabolic Reprogramming
Parte 09 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 05/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
O predomínio funcional do sítio ativo sobre a regulação alostérica: uma análise cinética e metabólica integrada
A regulação alostérica é tradicionalmente descrita como um mecanismo hierarquicamente superior ao controle exercido pelo sítio ativo, especialmente em enzimas-chave de vias centrais como a glicólise. No entanto, essa hierarquização reflete modelos normativos derivados de sistemas isolados e controlados, não descrevendo integralmente o comportamento metabólico real em ambientes celulares dinâmicos. Em sistemas vivos, o fluxo de substrato, a compartimentalização celular, a superexpressão enzimática e a pressão energética sistêmica impõem limites práticos à eficácia funcional da regulação alostérica.
Este texto demonstra, com base em cinética enzimática aplicada ao contexto celular real, termodinâmica metabólica e observação funcional do controle de fluxo, que, em condições específicas, o sítio ativo pode assumir predominância funcional sobre a regulação alostérica. Essa predominância não decorre de competição estrutural direta, mas da imposição sistêmica do fluxo metabólico, na qual mecanismos regulatórios finos tornam-se secundários frente à necessidade de continuidade metabólica.
É fundamental esclarecer um ponto frequentemente que considero mal interpretado. O substrato nunca compete fisicamente com o modulador alostérico. Ele superar funcionalmente a regulação alostérica não significa que devo deslocá-la ou anulá-la, mas sim reduzir sua relevância prática no controle do fluxo metabólico global. Assim, a questão central não é estrutural, mas funcional e sistêmica.
Palavras-chave: Câncer-de-mama, reprogramação-do-metabolismo-celular, sítio-ativo, regulação-alostérica
Abstract
Allosteric regulation is traditionally described as a mechanism hierarchically superior to control exerted at the active site, especially in key enzymes of central pathways such as glycolysis. However, this hierarchy reflects normative models derived from isolated and controlled systems and does not fully describe real metabolic behavior in dynamic cellular environments. In living systems, substrate flux, cellular compartmentalization, enzymatic overexpression, and systemic energetic pressure impose practical limits on the functional effectiveness of allosteric regulation.
This text demonstrates, based on enzyme kinetics applied to the real cellular context, metabolic thermodynamics, and functional observation of flux control, that under specific conditions the active site can assume functional predominance over allosteric regulation. This predominance does not arise from direct structural competition, but from the systemic imposition of metabolic flux, in which fine regulatory mechanisms become secondary to the need for metabolic continuity.
It is essential to clarify a point that I consider to be frequently misunderstood. The substrate never physically competes with the allosteric modulator. Functionally overcoming allosteric regulation does not mean displacing or nullifying it, but rather reducing its practical relevance in the control of global metabolic flux. Thus, the central issue is not structural, but functional and systemic.
Keywords: Breast-cancer; cellular-metabolic-reprogramming; active-site; allosteric-regulation.
Introdução
Os modelos clássicos de interação enzima/substrato, como chave–fechadura (Fischer) e encaixe induzido (Koshland), foram desenvolvidos dentro de um formalismo cinético rigoroso e representam marcos fundamentais da bioquímica. A equação de Michaelis-Menten, formulada por Leonor Michaelis e Maud Menten em 1913, descreve uma dependência da velocidade de reações enzimáticas em função de uma concentração de substrato, sob condições idealizadas.
Posteriormente, Lineweaver e Burk introduziram uma representação gráfica linearizada da equação de Michaelis-Menten, que permiti uma estimativa de parâmetros como Vmax e Km, além da classificação didática dos tipos de inibição:
- Competitiva (Km aumenta, Vmax permanece constante)
- Não competitiva (Vmax diminui, Km permanece constante)
- Incompetitiva (Vmax e Km diminuem)
Bem essas classificações realmente são corretas mais dentro de um contexto para o qual foram concebidas: enzimas isoladas, parâmetros constantes e ausência de influência sistêmica. No entanto, tornam-se insuficientes quando são aplicadas diretamente a sistemas metabólicos reais, nos quais o metabolismo opera sob condições variáveis, não lineares e frequentemente extremas, como ocorre no caso do citrato na celula mamária.
O problema central desses modelos normativos é tratar a inibição como um evento local e isolado, onde sugere-se que o aumento da concentração de substrato poderia “ultrapassar” qualquer bloqueio enzimático. Mais essa interpretação ignora a distinção entre controle cinético local e controle metabólico sistêmico.
O equívoco conceitual na interpretação do papel do citrato
esses modelos clássicos não conseguem descrever adequadamente por que o citrato, como um modulador alostérico, não é funcionalmente superado pelo aumento de substrato no sítio ativo. Isso gera um erro conceitual recorrente: pois assumir que o citrato deveria competir com o substrato, o que nunca ocorreu biologicamente (no contexto diferenciado em que a celula de mama se encontra), isso é uma realidade, não teoria.
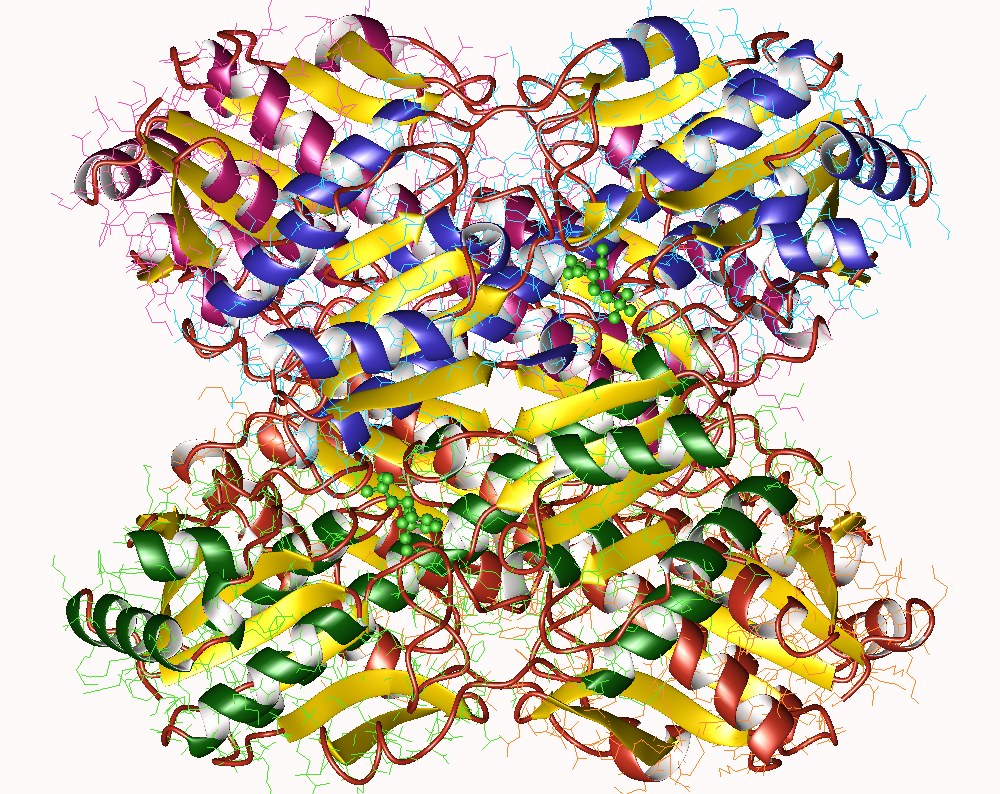
No caso da fosfofrutoquinase-1 (PFK-1), o citrato liga-se a um sítio alostérico regulatório, estabilizando a conformação T (menos ativa) e reduzindo a fração cataliticamente competente da enzima. Esse processo não altera o Km para frutose-6-fosfato, mas reduz o Vmax observado. Portanto, o que se ver é que não há competição física entre frutose-6-fosfato (sítio ativo) e citrato (sítio alostérico) isso é uma realidade, não teoria..
Demonstração funcional da inibição alostérica não competitiva
Para fins descritivos, a inibição alostérica pode ser expressa como:
v = (Vmax / α) [S] / (Km + [S])
Onde: α > 1 representa a redução da fração cataliticamente funcional, o Km permanece estruturalmente constante e a Vmax observado é reduzido
Resumo funcional:
O aumento de [S] não restaura o Vmax observado, pois o efeito do citrato não atua sobre a afinidade pelo substrato, mas sobre a capacidade catalítica global.
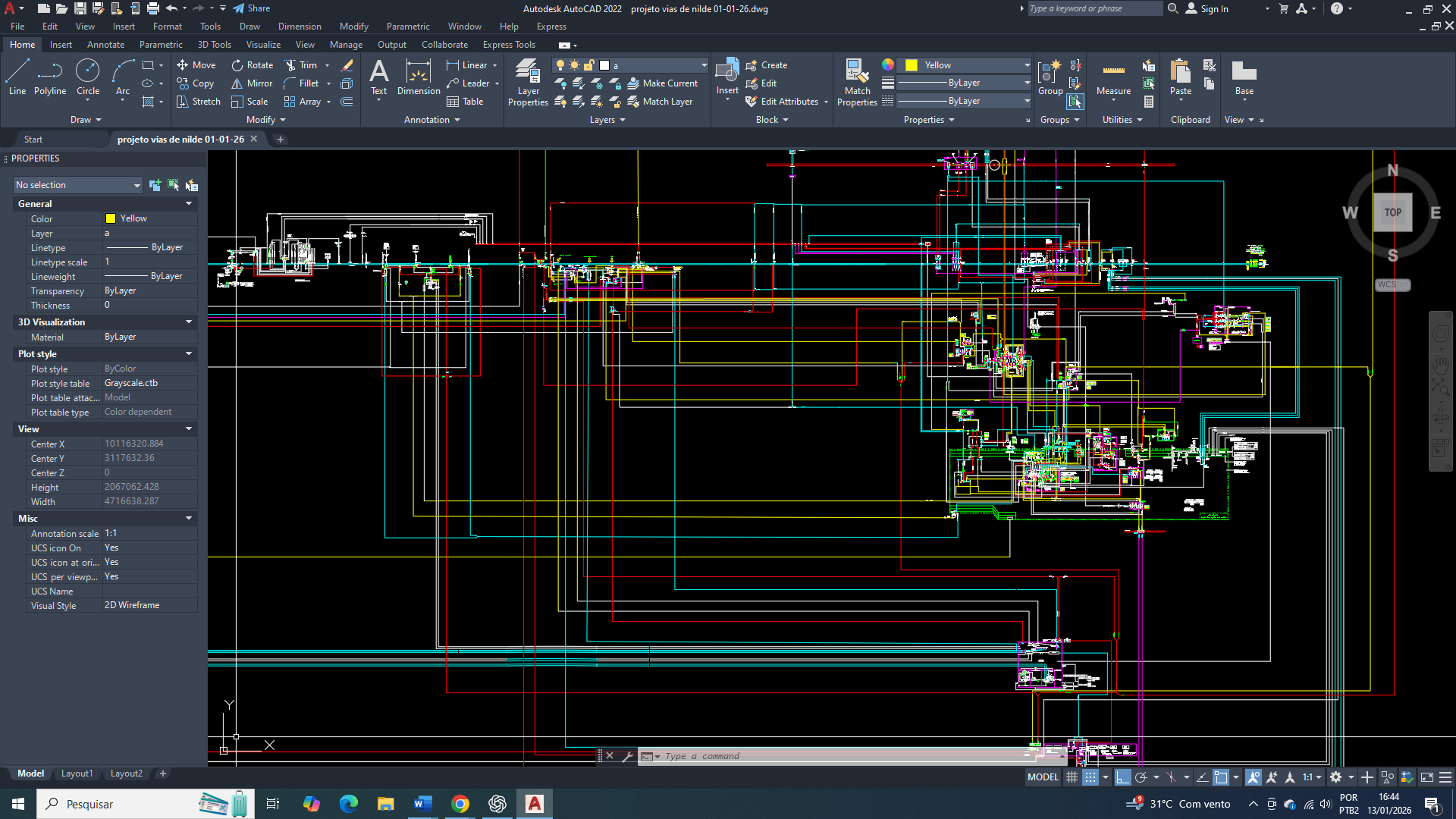
Um ambiente metabólico normal de uma célula de mama com alta concentração de citrato no citosol indica:
• mitocôndria plenamente funcional
• ciclo de Krebs ativo
• ATP elevado
• NADH elevado
• acetil-CoA abundante
Esse conjunto sinaliza um estado energético confortável, convergindo para:
• desaceleração da glicólise
• redirecionamento de carbono para lipogênese
• favorecimento de armazenamento e biossíntese
Nesse contexto normativo, o citrato atua como sinalizador global do estado energético.
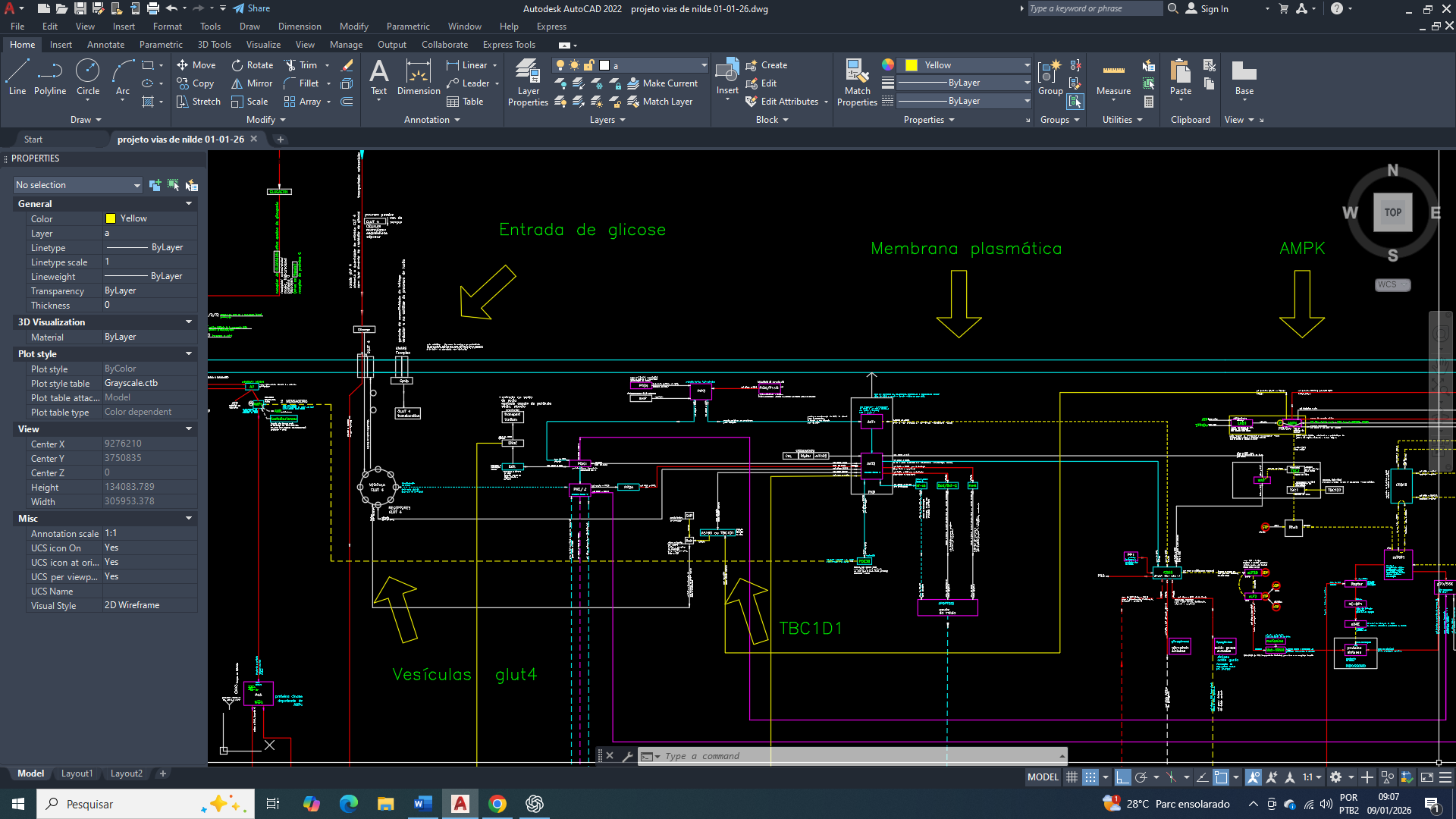
Mais no cenário metabólico real, no caso da célula tumoral de mama (é diferenciado), pois a alta concentração de citrato no citosol coexistir com:
• mitocôndria disfuncional
• ciclo de Krebs parcialmente comprometido
• ATP em baixa concentração
• NAD⁺ e AMP elevados
• acetil-CoA citosólico abundante
Esse quadro reflete uma reprogramação metabólica na qual os sinais clássicos mudam a coerência funcional diferente, convergindo paradoxalmente para:
• aceleração da glicólise
• redirecionamento de carbono para lipogênese
• favorecimento de armazenamento e biossíntese
Bem nesse contexto, o citrato não deixa de exercer o seu papel alostérico, mas sua capacidade de sinalizar o estado energético global torna-se funcionalmente para outros objetivos.
(Meu ponto de vista sobre esse contexto).
Ponto central
O citrato não falha em competir com o sítio ativo da glicólise porque nunca participou dessa competição. Seu papel é modular alostericamente a arquitetura funcional da enzima. No entanto, em ambientes metabólicos de alta pressão de fluxo, essa modulação não é suficiente para interromper a continuidade da via glicolítica que é solicitada por demanda no metabolismo. A glicólise, nesses casos, não é governada por saturação de substrato isoladamente nem por regulação alostérica isolada, mas pela imposição sistêmica do fluxo metabólico para manter um equilíbrio energético mínimo, priorizando a sobrevivência celular.
Diferenciação (conceitual): superar não é competir
• O substrato nunca compete fisicamente com o modulador alostérico.
• Superar funcionalmente a alosteria significa reduzir seu impacto prático sobre o fluxo, não eliminá-la.
Assim, a questão permanece funcional, não estrutural.
Retorno ao protagonismo funcional do sítio ativo
Em modelos clássicos, assume-se que Vmax efetivo seja uma constante reduzida. Em um ambiente celular real, essa suposição dificilmente pode se sustenta, pois a fração funcional da enzima varia continuamente em função de expressão, isoformas, acoplamento metabólico e demanda sistêmica.
Em sistemas altamente glicolíticos:
• [S] ≫ Km
• enzimas estão superexpressas
• isoformas menos sensíveis à alosteria predominam
• o fluxo é imposto por efeito de massa
Dentro dessas condições, se observa que o fluxo aproxima-se mais do limite catalítico, não porque a alosteria desapareçe, mas porque a sua elasticidade funcional torna-se marginal frente à necessidade sistêmica de fluxo (solicitando).
Saturação funcional do sítio ativo
Quando a concentração de substrato excede amplamente Km, a ocupação do sítio ativo vai se torna praticamente contínua. O tempo de residência do substrato passa a dominar a cinética observável, e as variações conformacionais induzidas alostericamente começam a deixar de produzir um impacto significativo no tempo fisiológico relevante.
Durante esse regime de funcionamento, o complexo enzima–substrato forma-se mais rapidamente do que os mecanismos regulatórios conseguem reduzir a continuidade catalítica.
Controle de fluxo distribuído sob imposição sistêmica
É um erro atribuir o controle do fluxo metabólico a uma única enzima. Pois o controle é distribuído e, sob entrada maciça de substrato, a elasticidade alostérica local diminui drasticamente. Sendo assim, o sítio ativo passa a operar como um canal de passagem imposto pelo sistema, enquanto a alosteria vai atua apenas como ajuste fino.
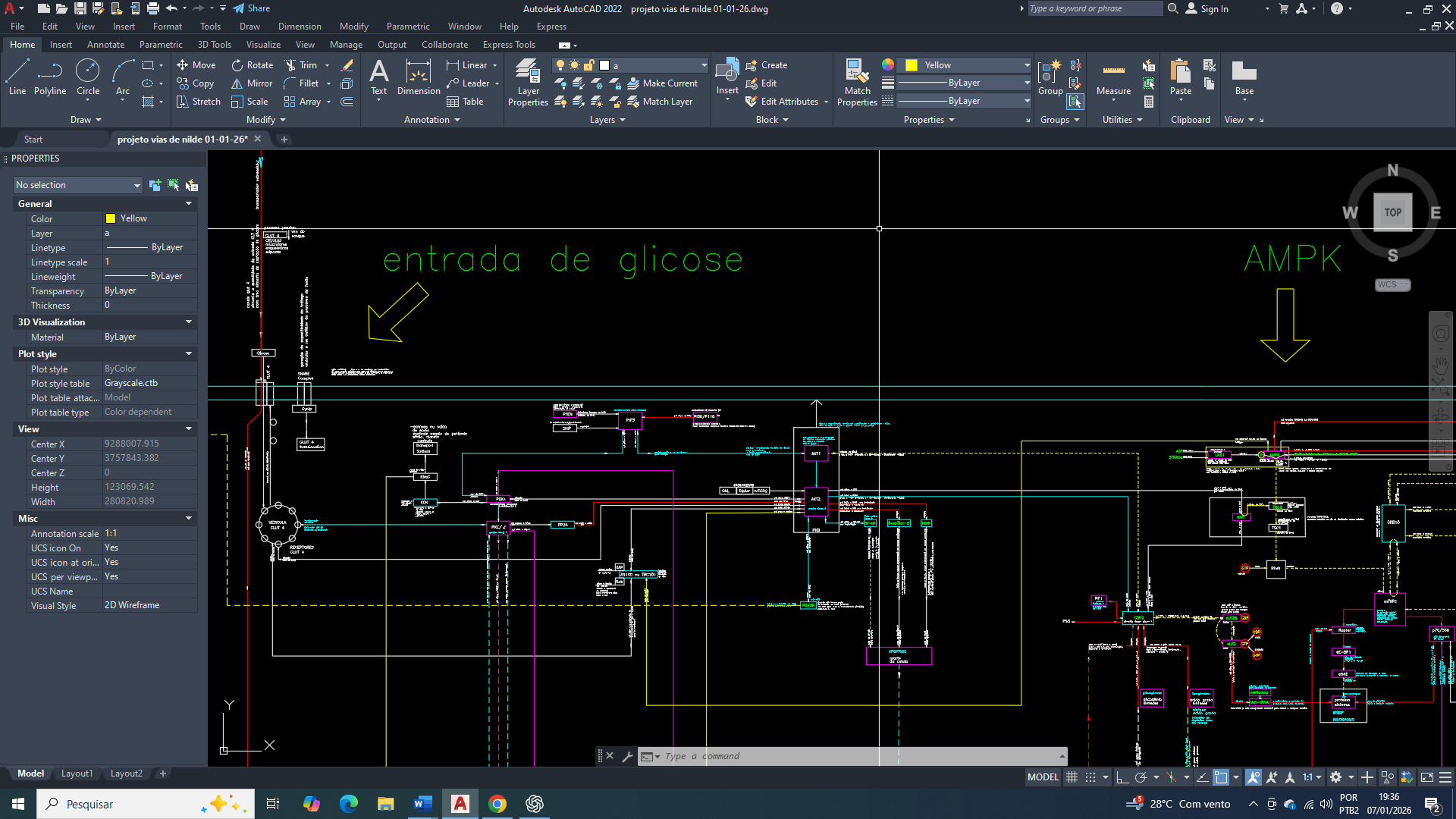
Caso aplicado: glicólise em ambiente hiperglicolítico
Em células tumorais e tecidos inflamatórios sob hiperglicemia local, observa-se:
• glicose elevada
• frutose-6-fosfato saturante
• PFK-1 operando próximo ao limite catalítico observado
• citrato presente, mas incapaz de interromper o fluxo
Isso não invalida a ação da alosteria, mas demonstra que tem limites funcionais em regimes metabólicos extremos.
Síntese conceitual
• O sítio alostérico regula a probabilidade de catálise.
• O sítio ativo materializa a catálise quando o fluxo é imposto pelo sistema.
Isso ocorre quando o ambiente metabólico impõe:
- saturação de substrato
- alta densidade enzimática
- necessidade sistêmica de fluxo
Resultando em uma predominância funcional do sítio ativo, não por antagonismo estrutural, mas por domínio cinético e termodinâmico imposto pela realidade metabólica diferenciada.
Conclusão
A noção de uma supremacia absoluta da regulação alostérica deriva da extrapolação de modelos normativos in vitro. Em sistemas vivos, especialmente sob regimes de alta demanda energética, (que é o nosso caso), sendo assim o metabolismo pode operar em modo de imposição de fluxo, no qual mecanismos regulatórios finos tornam-se secundários.
Bem amigos, nesses contextos, não é uma norma teórica que governa a reação, mas sim a realidade metabólica que impõe o destino funcional da enzima (é a realidade que indica a situação).
O meu Deus é Pai, diz em Mateus 7:16-20: ‘Pelos seus frutos os conhecereis`.
Referências:
Fosfofrutoquinase 1
https://pt.wikipedia.org/wiki/Fosfofrutoquinase_1
Enzima
https://pt.wikipedia.org/wiki/Enzima