Breast Cancer: Mitochondrial Citrate Export in the Continuity of Cellular Metabolic Reprogramming
Parte 6 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 26/12/2025
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Reprogramação metabólica diferenciada no eixo citrato–malato–enzima málica no câncer de mama
Resumo
Bem amigos, A reprogramação metabólica é a característica central do câncer de mama e que envolve alterações profundas no metabolismo mitocondrial e citosólico. Para que tudo se mantenha dentro das regras já pré definidas.
Neste post, vamos tentar descrever de forma integrada qual será o papel do eixo citrato–malato–enzima málica na sustentação da biossíntese, do equilíbrio redox e da sobrevivência proliferativa da célula mamária cancerígena.
Obs. Este é apenas um pequeno ponto, em um grande contexto.
Para que o citrato produzido na matriz mitocondrial continue sendo transportado para o citosol, ocorre a ativação do transportador mitocondrial SLC25A1, também conhecido como antiportador citrato–malato. Esse sistema funciona através um mecanismo de uma troca obrigatória, no qual uma molécula de citrato é exportada da mitocôndria em contrapartida à importação de uma molécula de malato, obedecendo a uma relação estequiométrica estrita de 1:1.
Esse acoplamento impõe uma exigência metabólica específica, que é a manutenção contínua de um pool citosólico de malato capaz de sustentar a exportação de citrato. Assim, torna-se necessária uma reprogramação metabólica coordenada do eixo citrato–malato–enzima málica, garantindo simultaneamente a lipogênese citosólica, a geração de poder redutor com uma estabilidade funcional do metabolismo mitocondrial.
Para que tudo funcione de maneira correta a exportação de citrato, associada à conversão citosólica de oxaloacetato em malato e ao desvio predominante deste para a enzima málica, estabelece um estado funcional de energia independente da fosforilação oxidativa plena, porém como vimos anteriormente, deliberadamente limitado em eficiência energética. Esse arranjo metabólico confere uma elevada plasticidade e resistência ao estresse metabólico e terapêutico, destacando o eixo citrato–malato–enzima málica como um possivel alvo estratégico para intervenções combinatórias no câncer de mama.
Palavras-chave: câncer de mama; reprogramação metabólica; citrato; malato; enzima málica; NADPH; metabolismo energético.
Abstract
Metabolic reprogramming is the central hallmark of breast cancer and involves profound alterations in both mitochondrial and cytosolic metabolism, in order to keep all processes operating within previously defined rules.
In this post, we aim to describe in an integrated manner the role of the citrate–malate–malic enzyme axis in sustaining biosynthesis, redox balance, and the proliferative survival of the breast cancer cell.
Note: This represents only a small point within a much broader context.
For citrate produced in the mitochondrial matrix to continue being transported to the cytosol, activation of the mitochondrial transporter SLC25A1—also known as the citrate–malate antiporter—occurs. This system operates through an obligatory exchange mechanism, in which one citrate molecule is exported from the mitochondrion in exchange for the import of one malate molecule, strictly following a 1:1 stoichiometric ratio.
This coupling imposes a specific metabolic requirement: the continuous maintenance of a cytosolic malate pool capable of sustaining citrate export. Thus, a coordinated metabolic reprogramming of the citrate–malate–malic enzyme axis becomes necessary, ensuring cytosolic lipogenesis, generation of reducing power, and functional stability of mitochondrial metabolism simultaneously.
For this system to function properly, citrate export—associated with the cytosolic conversion of oxaloacetate to malate and the predominant shunting of malate toward the malic enzyme—establishes a functional energetic state that is partially independent of full oxidative phosphorylation. However, as discussed previously, this state is deliberately limited in energetic efficiency. This metabolic arrangement confers high plasticity and resistance to metabolic and therapeutic stress, highlighting the citrate–malate–malic enzyme axis as a potential strategic target for combinatorial interventions in breast cancer.
Keywords: Breast cancer; metabolic reprogramming; citrate; malate; malic enzyme; NADPH; energy metabolism.
Introdução
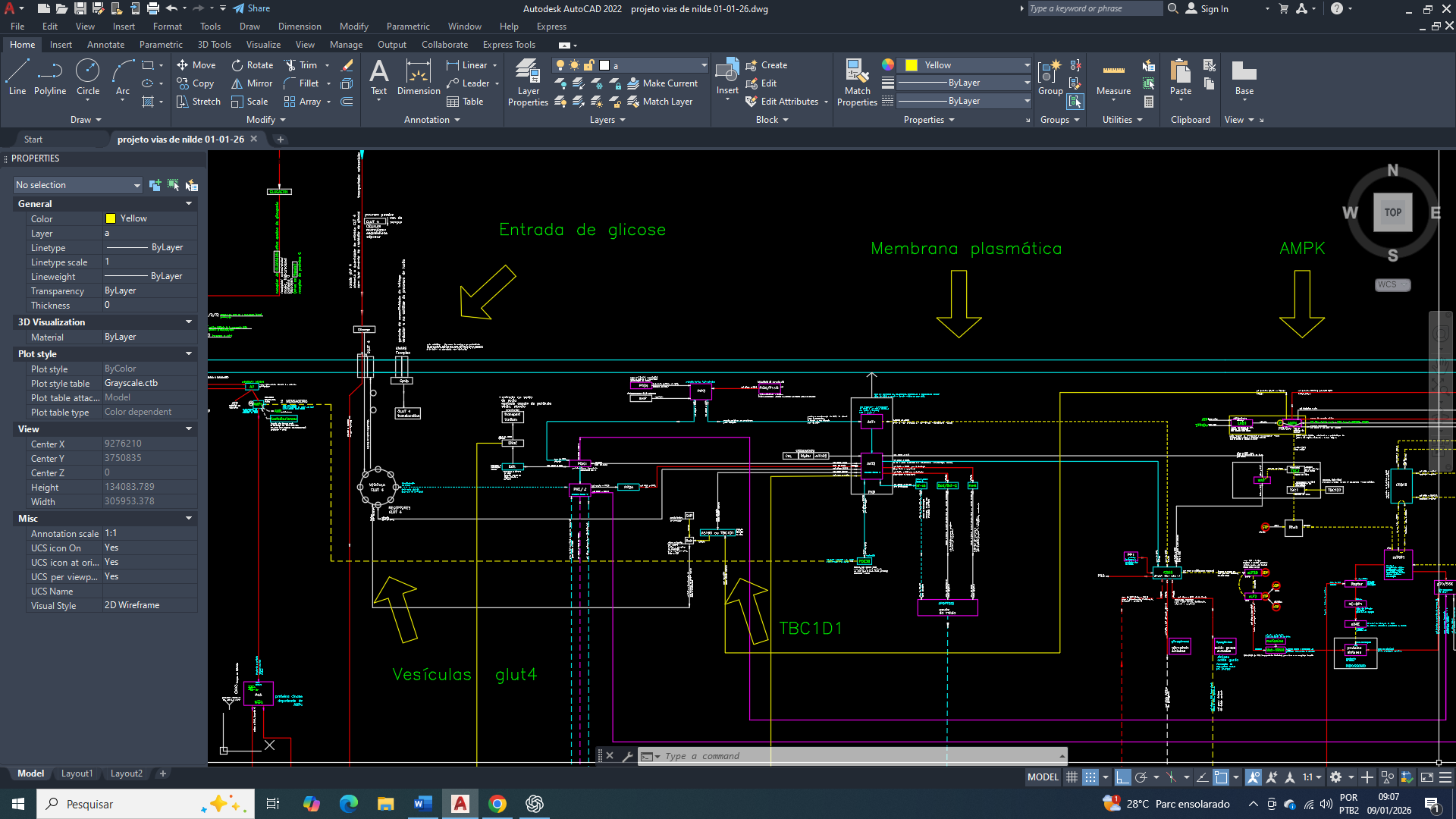
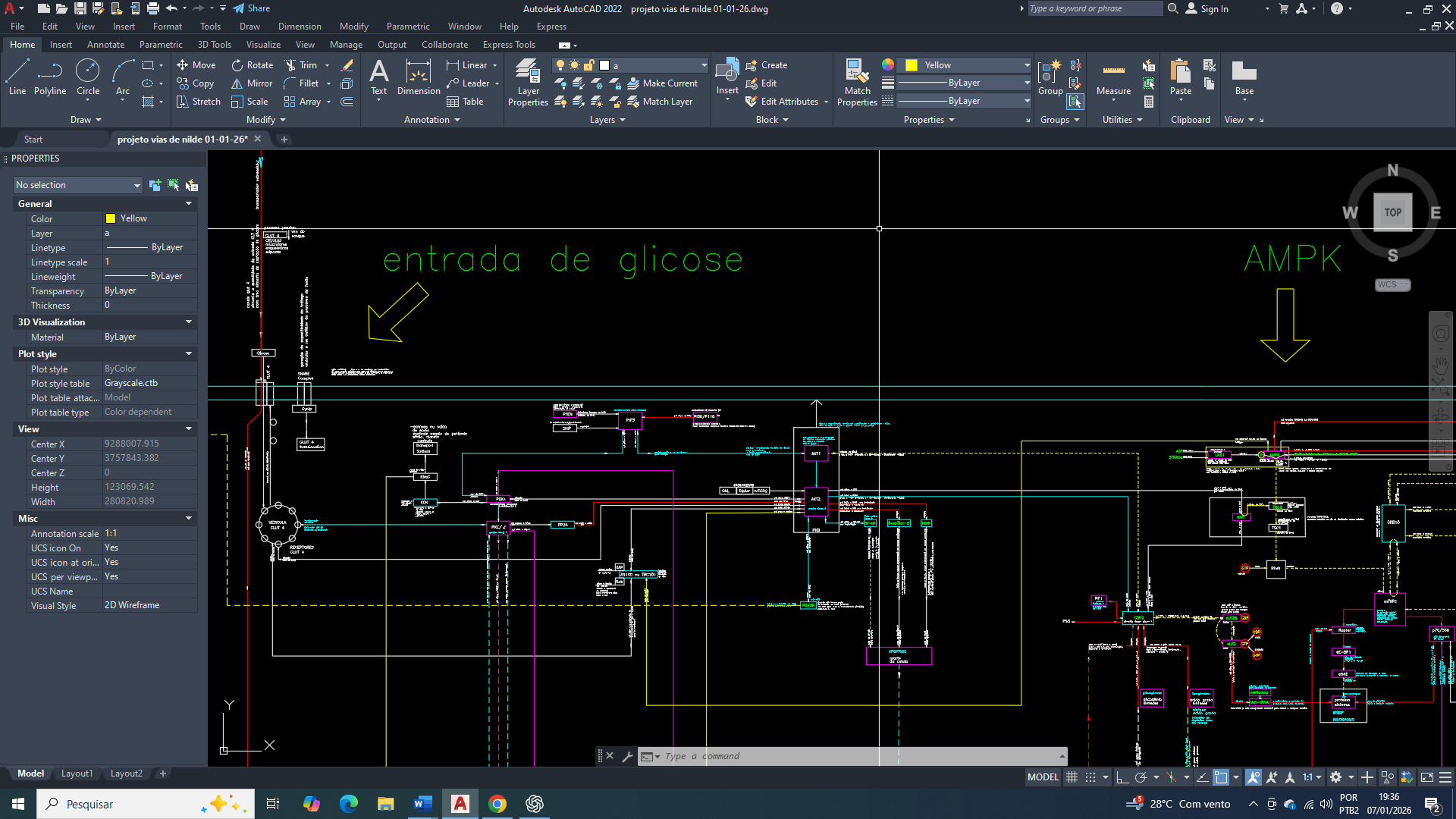
O câncer de mama apresenta profunda remodelação metabólica, que vai além do aumento da glicólise aeróbica descrito pelo efeito Warburg. Em vários estudos evidências indicam que a célula tumoral não busca maximizar a produção de ATP, mas sim para reorganizar seus fluxos metabólicos para pode sustentar biossíntese, controle redox e adaptação a microambientes metabolicamente adversos. Então Nesse contexto, a mitocôndria vai permanece funcional, porém vai assume um papel predominantemente biossintético e regulatório, em vez de atuar como principal fonte de energia oxidativa.
Entre os múltiplos eixos metabólicos envolvidos nessa adaptação, o circuito formado pela exportação de citrato, geração de malato citosólico e sua conversão pela enzima málica aparece como um dos principais mecanismos de suporte para à proliferação tumoral no câncer de mama.
Obs. Com outras possibilidades de regulação.

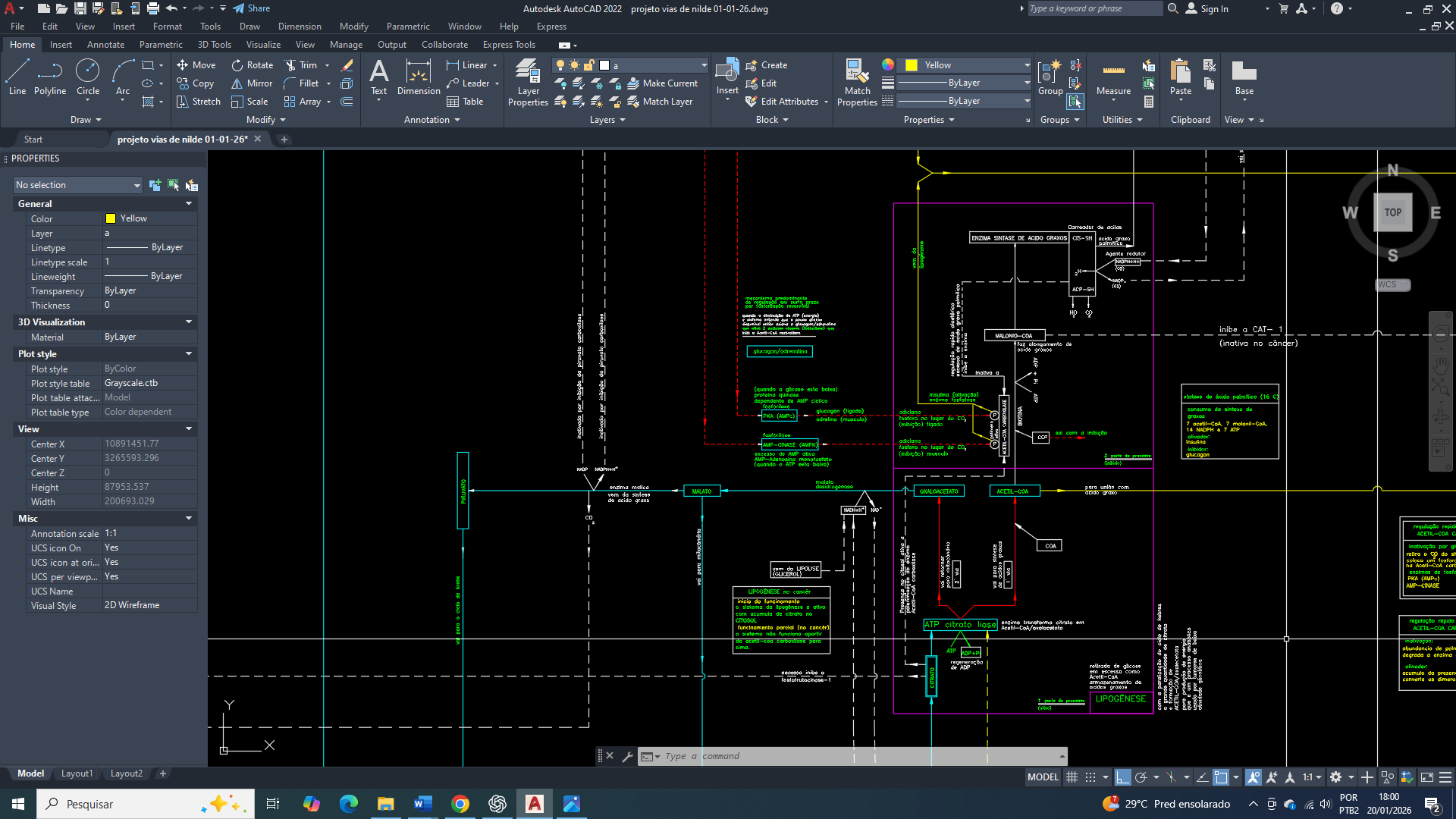
projeto de visão geral e simplificada do funcionamento integrado da célula de mama
Exportação mitocondrial de citrato e truncamento funcional do TCA
Na célula mamária cancerígena, o ciclo de Krebs do ácido tricarboxílico (TCA) encontra-se funcionalmente truncado. Uma fração significativa do citrato mitocondrial não é direcionada para a oxidação completa, sendo exportada para o citosol por meio do transportador mitocondrial de citrato (SLC25A1).
A célula precisa retirar o citrato do interior da mitocôndria, para que o sistema continuei fluindo de maneira linear. Se não, todo o metabolismo será travado.
Essa exportação representa um desvio estratégico de carbono, priorizando a geração de precursores biossintéticos. No citosol, o citrato é clivado pela enzima ATP-citrato liase (ACLY), produzindo acetil-CoA citosólico, essencial para a lipogênese de ácidos graxos e colesterol, e oxaloacetato.
Esse processo reduz deliberadamente o fluxo oxidativo do ciclo de Krebs TCA, ao mesmo tempo em que vai sustenta a expansão de membranas celulares, característica fundamental da proliferação tumoral.
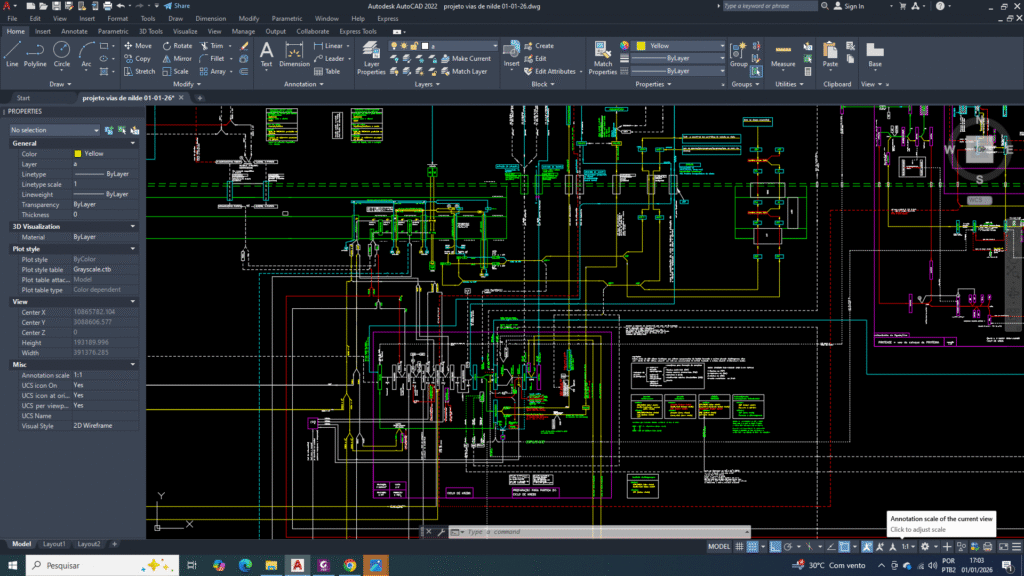
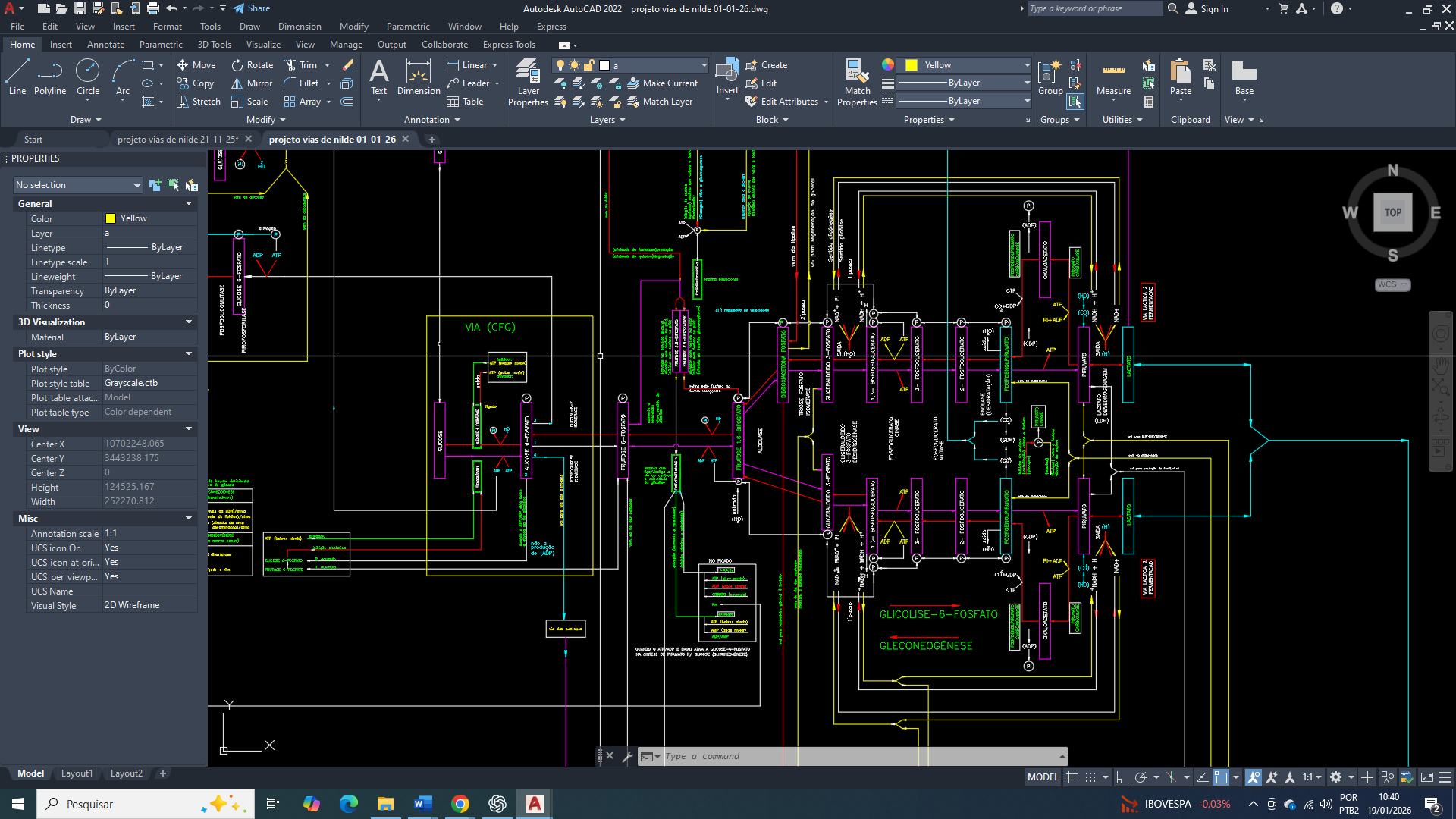
visão simplificada do funcionamento integrado da produção de citrato na mitocôndria
Conversão citosólica de oxaloacetato em malato e formação de um pool metabólico estratégico
As moléculas de oxaloacetato no citosol depois da lise pela ATP citrato liase, não consegue atravessa diretamente a membrana mitocondrial. Dessa forma, ele é rapidamente convertido em malato pela malato desidrogenase citosólica (MDH1), em uma reação dependente de NADH.
A elevada atividade glicolítica da célula tumoral mantém um estado redox citosólico favorável à regeneração contínua de malato, isso vai resultar na formação de um pool metabólico abundante. Esse pool de malato torna-se um ponto central de redistribuição de fluxos metabólicos, conectando biossíntese, controle redox e comunicação mitocôndria–citosol.
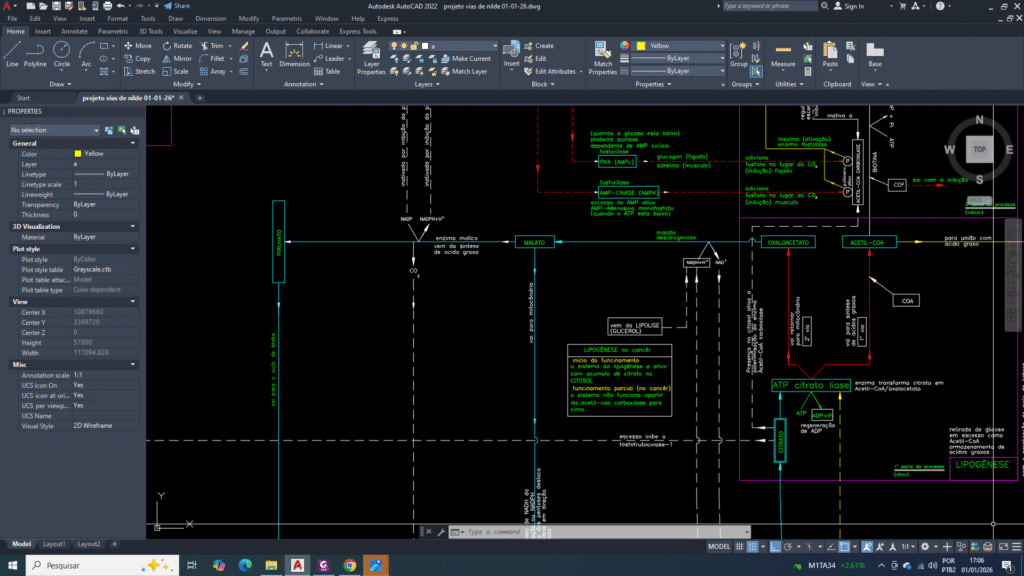
visão simplificada do funcionamento integrado da retorno de malato ou piruvato para mitocôndria
Vamos nos concentrar no destino metabólico do malato citosólico no câncer de mama. Quem vai entrar na mitocôndria (o malato ou piruvato), qual será o fluxo dominante?
Conversão de malato em piruvato pela enzima málica:
O principal destino do malato citosólico no câncer de mama é sua conversão em piruvato pela enzima málica citosólica (ME1). Essa reação gera NADPH, que é um cofator essencial para a sobrevivência tumoral. (porquê)?
O NADPH produzido sustenta:
- A lipogênese dependente de acetil-CoA citosólico
- A manutenção do estado redox
- A neutralização de espécies reativas de oxigênio
- A resistência ao estresse metabólico e terapêutico
Atravez de varios estudos. Estimativas funcionais indicam que aproximadamente de 60% a 75% do malato citosólico é direcionado para essa via, tornando a enzima málica um dos elementos de muita importância na reprogramação metabólica tumoral.
As vantagens do piruvato gerado nesse contexto, é que ele pode ser reciclado para a mitocôndria de forma regulada ou convertido em lactato, reforçando a flexibilidade metabólica da célula cancerígena.
Mais a célula mamaria, continua precisando do retorno do malato à mitocôndria via antiporte citrato–malato.
Isso acontecerá, porquê uma fração controlada do malato citosólico é transportada de volta à mitocôndria em troca da exportação de citrato. Esse fluxo, mediado pelo transportador SLC25A1, isso é estruturalmente obrigatório, pós impedirá a parada do metabolismo pelo acumulo de citrato na mitocôndria.
(Tendo por consequência a continuidade da lipogênese citosólica).
Entretanto, esse retorno será rigidamente limitado, pós corresponderá apenas 20% a 30% do pool de malato.
Como a reprogramação metabólica vesolve isso?
A célula tumoral garante esse fluxo mínimo por meio da superprodução de malato e do suporte anaplerótico que vem da glutaminólise, evitando que a atividade da enzima málica comprometa a exportação contínua de citrato na mitocôndria.
Vamos entender como tudo funciona.
Situação inicial: citrato exportado da mitocôndria
Na célula cancerígena de mama:
Na célula cancerígena de mama o citrato sai da mitocôndria para o citosol (via transportador de citrato). No citosol, a ATP-citrato liase converte citrato em Acetil-CoA (que vai para lipogênese) e Oxaloacetato.
Esse passo já indica que a célula vai prioriza biossíntese, não oxidação completa.
Obs. mais o oxaloacetato citosólico não consegue atravessa membrana mitocondrial diretamente.
O oxaloacetato é reduzido a malato pela malato desidrogenase citosólica (MDH1), consumindo NADH. (Até aqui, não há escolha, é uma fase obrigatória).
O ponto principal da decisão metabólica (O malato citosólico pode te dois destinos possíveis):
Opção A
O malato entra na mitocôndria, para regenerar oxaloacetato no TCA e favorecer a oxidação energética clássica.
(Essa via não é a preferida na célula cancerígena).
Opção B
O malato se mantém no citosol e depois é convertido a piruvato pela enzima málica (ME1), com a produção de uma molecula de NADPH e a saida de um CO₂
(Essa será a via dominante no câncer de mama).
A pergunta é, por que a via da enzima málica prevalece?
Porque de maneira automática e por demanda, vai se atender três necessidades centrais da célula tumoral:
1 – Produção de NADPH para lipogênese se manter ativa.
A produção de NADPH, pela enzima málica, quê capita o NADP da reação feita pela enzima sintase de acido graxos, mantendo uma ativação permanente da lipogênese, isso é essencial para manter a exportação do citrato para citosol. Mantendo a Manutenção do estado redox com a Neutralização de ROS.
Obs. A enzima málica é uma fonte rápida de produção de NADPH.
2 – Controlar o estado energético sem depender da mitocôndria
O piruvato gerado pode entrar na mitocôndria de forma regulada e ser convertido em lactato (efeito Warburg), Isso vai desacopla crescimento celular da fosforilação oxidativa.
3 – Evita sobrecarga mitocondrial
A mitocôndria no câncer continua sendo ativa, mas não é mais o eixo central da produção de energia, ela agora vai ser usada como plataforma biossintética, não oxidativa
conclusão
Na célula mamária cancerígena vai prevalecer:
O oxaloacetato sendo convertido em malato, que depois é convertido a piruvato (via enzima málica) e tem um retorno controlado à mitocôndria ou conversão a lactato (será visto em outro post).
O malato vai servir predominantemente como substrato da enzima málica, pois essa via maximiza NADPH, biossíntese lipídica e flexibilidade metabólica, características essenciais da reprogramação tumoral.
Oxidação completa no Ciclo de Krebs clássico.
A oxidação completa do malato no Ciclo de Krebs clássico, representa um fluxo residual, raramente excedendo 10%. A mitocôndria permanece funcional, mas sua capacidade oxidativa é deliberadamente subexplorada, reforçando o caráter não oxidativo da reprogramação metabólica tumoral.
Estabelecimento de um estado energético independente, porém limitado
A reorganização do eixo citrato–malato–enzima málica, vai resultar em um estado metabólico caracterizado como energia independente, porém limitada. A independência decorre da capacidade da célula de sustentar proliferação sem depender da fosforilação oxidativa plena, utilizando glicólise, NADPH citosólico e reciclagem de piruvato.
Por outro lado, a limitação energética emerge da retirada contínua de intermediários do Ciclo de Krebs e do desvio de malato para a produção de NADPH, restringindo a eficiência máxima da produção de ATP. Essa limitação não representa uma falha metabólica, mas uma adaptação estratégica voltada à sobrevivência e à progressão tumoral.
Implicações terapêuticas
Apesar de o eixo citrato–malato–enzima málica apresentar elevada importância na reprogramação metabólica e ser apontado como uma potencial abordagem terapêutica, uma vez que esse sistema promove uma produção sustentada de NADPH, permitindo à célula tumoral manter o equilíbrio redox mesmo sob disfunção mitocondrial parcial, a sua inibição tende a apresentar uma baixa eficiência terapêutica. Isso ocorre porque a célula mamária cancerígena dispõe de outras configurações metabólicas capazes de alcançar o mesmo objetivo: a manutenção do equilíbrio redox, mesmo diante de uma disfunção mitocondrial parcial.
OBS.: Essa configuração também será transitória durante a reprogramação celular (programação FTORPEDO), sendo substituída por outra, de acordo com a adaptação do metabolismo da célula tumoral mamária.
(Será detalhado em outro post mais a frente).
Uma abordagem terapêutica focada na interrupção efetiva desse sistema requer estratégias combinatórias que atinjam, simultaneamente, a exportação de citrato, a regeneração de malato e a atividade da enzima málica. No entanto, tal intervenção não comprometeria apenas a plasticidade metabólica tumoral, mas também a das células de comportamento normal, resultando em maior incidência de efeitos colaterais do que em benefícios terapêuticos. Ou uma ação fatal para o paciente.
Conclusão
No câncer de mama, a reprogramação metabólica não visa maximizar a produção de energia, mas de controlar a distribuição de carbono e poder redutor. O eixo citrato–malato–enzima málica desempenha papel importante nesse processo, estabelecendo um metabolismo funcionalmente independente da fosforilação oxidativa plena, porém estrategicamente limitado em eficiência energética. Essa organização metabólica sustenta biossíntese, equilíbrio redox.
Diante desse cenário, surge uma nova questão a ser analisada.
A questão central é a seguinte, se a adenilato cinase atua de forma eficiente no curto prazo para equilibrar as razões energéticas intracelulares (ATP/ADP/AMP), enquanto a lipogênese encontra-se plenamente ativada, promovendo a inibição funcional da CAT-1 (CPT-1), responsável pelo transporte de ácidos graxos para a mitocôndria e, consequentemente, bloqueando a β-oxidação, qual via metabólica efetivamente sustenta a produção de energia nessa célula durante essa fase da reprogramação metabólica?