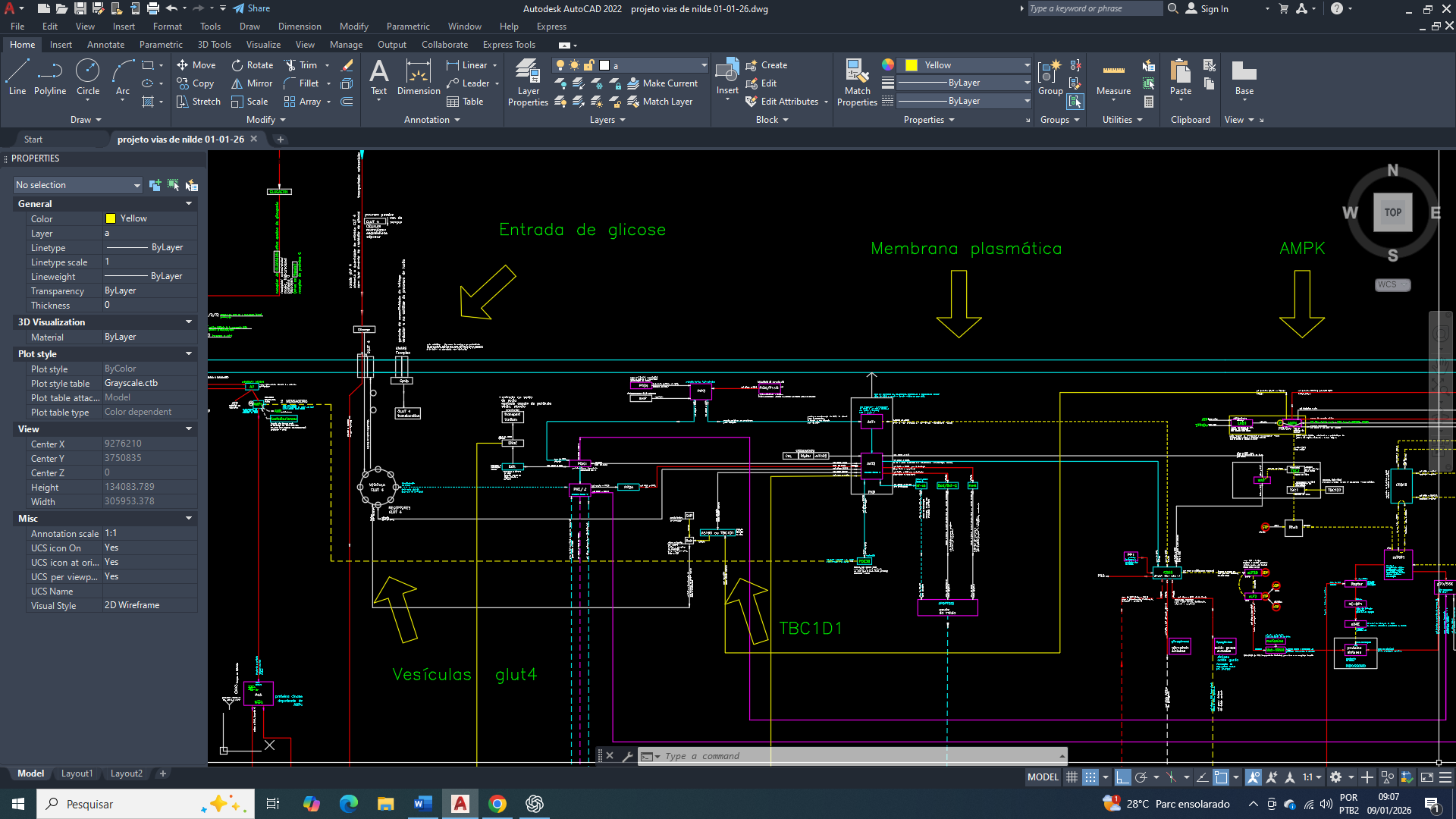
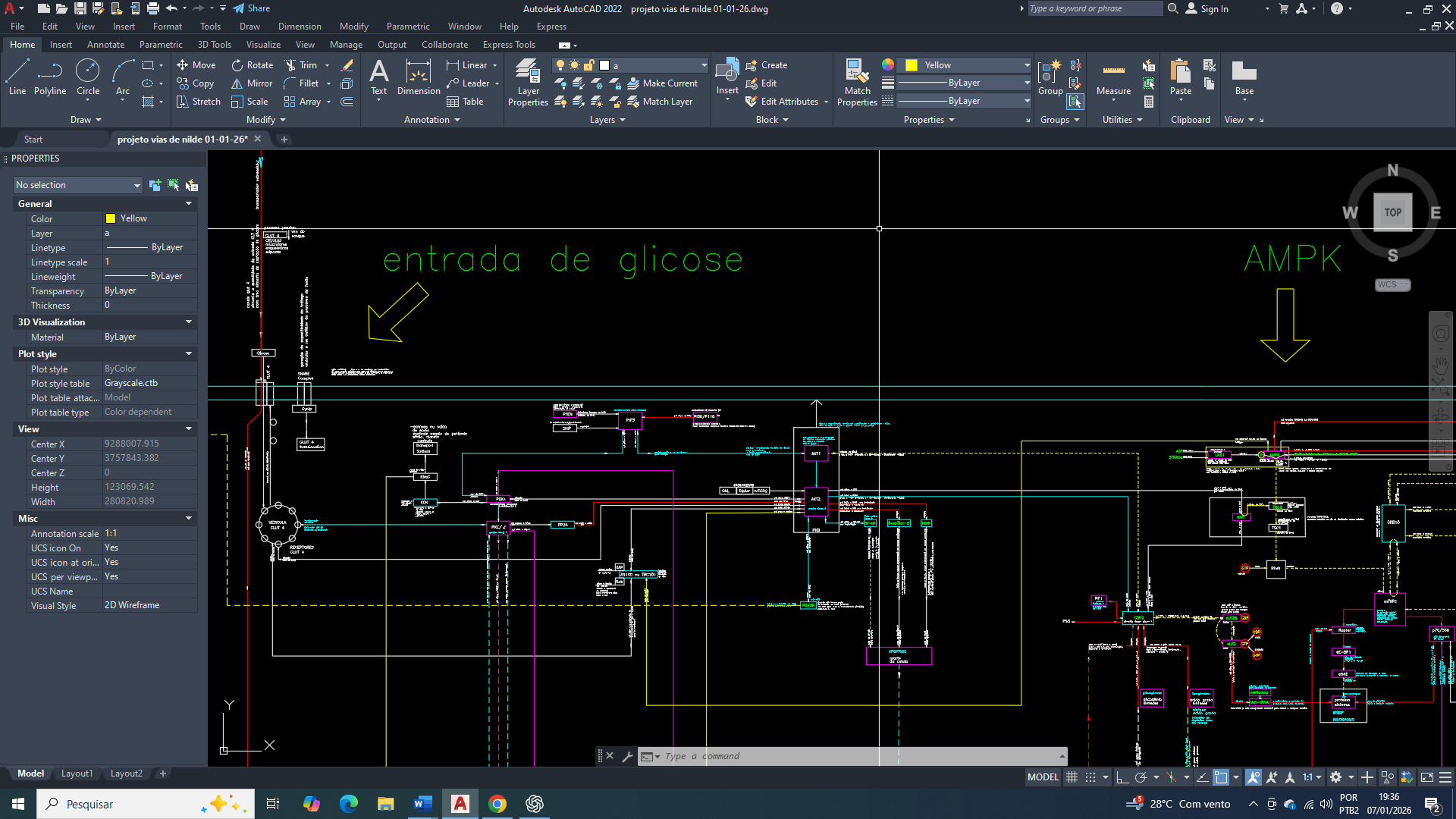
Breast Cancer: Limitations of Energy Homeostasis at the Onset of Cellular Metabolic Reprogramming
Parte 5 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 26/12/2025
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo.
Como vimos anteriormente, a célula mamária apresenta um problema sério, pois possui um tempo de vida reduzido. Isso ocorre porque o ciclo de Krebs teve sua velocidade de funcionamento diminuída, resultando em uma produção reduzida de NADH e FADH₂, moléculas que são utilizadas na cadeia respiratória para a produção de ATP (energia).
Reduzindo também a velocidade de produção de ATP pela cadeia respiratoria.
Como as células não “estocam” ATP (trifosfato de adenosina) da mesma forma que armazenam gordura ou glicogênio, o ATP é gerado continuamente e utilizado quase imediatamente para sustentar a atividade metabólica. Ou seja, a produção de ATP ocorre sob demanda, sendo consumido a cada reação metabólica que dele depende.
No contexto do estado funcional da célula mamária, a baixa produção de ATP é insuficiente para permitir que todas as reações químicas dependentes de ATP sejam completadas, resultando, como consequência, em um colapso progressivo do funcionamento de todo o metabolismo celular.
Ou seja, a célula mamária encontra-se em um processo de morte gradual; no entanto, esse processo ocorre dentro de um intervalo de tempo limitado, o qual será explorado a seu favor.
Nesse curto intervalo de tempo, um mecanismo automático entram em ação.
A enzima (adenilato cinase), que é de grande importância no início da reprogramação do metabolismo; entretanto, apesar de sua alta expressão na célula cancerígena, apresenta grande relevância para o tema central, pois a célula cancerígena já possui uma programação metabólica consolidada e irreversível e a molecula de AMP é crucial para isso.
(Isso será abordado em um post específico, dedicado exclusivamente a esse assunto.)
Palavras-chave: Câncer-de-mama, reprogramação-do-metabolismo-celular, homeostase-energética, NADH, FADH₂, ATP.
Abstract
As seen previously, the mammary cell faces a serious problem, as it has a reduced lifespan. This occurs because the Krebs cycle has a decreased operating rate, resulting in reduced production of NADH and FADH₂, molecules that are used in the respiratory chain for ATP (energy) production.
This also reduces the rate of ATP production by the respiratory chain.
Because cells do not “store” ATP (adenosine triphosphate) in the same way they store fat or glycogen, ATP is generated continuously and used almost immediately to sustain metabolic activity. In other words, ATP production occurs on demand and is consumed in each metabolic reaction that depends on it.
Within the functional state of the mammary cell, the low ATP production is insufficient to allow all ATP-dependent chemical reactions to be completed, resulting, as a consequence, in a progressive collapse of overall cellular metabolism.
In other words, the mammary cell is undergoing a process of gradual death; however, this process occurs within a limited time window, which will be exploited to its advantage.
Within this short time interval, an automatic mechanism comes into action.
The enzyme adenylate kinase is of great importance at the onset of metabolic reprogramming; however, despite its high expression in cancer cells, it is particularly relevant to the central theme because the cancer cell already possesses a consolidated and irreversible metabolic programming, and the AMP molecule is crucial to this process.
(This topic will be addressed in a specific post dedicated exclusively to this subject.)
Keywords: Breast cancer; cellular metabolic reprogramming; energy homeostasis; NADH; FADH₂; ATP.
INTRODUÇÃO
Fase – 05 do projeto (Vias de Nilde): Estabilidade energetica no início da reprogramação do metabolismo.
A adenilato Cinase (ADK), ou Adenilato Quinase, é uma enzima chave na homeostase energética celular, catalisando a interconversão de nucleotídeos de adenosina (ATP, ADP, AMP), principalmente convertendo duas moléculas de ADP em ATP gerando também AMP, ou vice-versa, mantendo o equilíbrio de energia e nucleotídeos na célula e sendo crucial para o metabolismo energético. Interferindo diretamente com a programação do metabolismo, pôr ter seu produto final a molecula de AMP. Que pode ser usado como sinalizador e substrato em outros processos.
A molécula de monofosfato de adenosina (AMP) desempenha funções cruciais no metabolismo energético e na sinalização celular. Trata-se de um nucleotídeo fundamental, atuando tanto como bloco estrutural do RNA quanto como um importante indicador do estado energético da célula. A função da enzima adenilato cinase vai além de um papel meramente energético, pois, em condições de estresse metabólico, o aumento relativo de AMP desencadeia uma série de alterações na programação celular, com o objetivo principal de preservar a sobrevivência da célula.
Outra coisa que tem que ficar claro, e que A adenilato cinase não “produz AMP como seu objetivo final”, mas catalisa a reação reversível onde 02 ADP ⇌ ATP + AMP
Mas e evidente que o aumento relativo de AMP ocorre quando a célula está sob estresse energético, que o conecta diretamente no contexto do qual o ciclo de krebs se encontra na mitocôndria.
Em condições normais de repouso, a célula mantém uma alta proporção de ATP para AMP/ADP. Um aumento na concentração de AMP indica que o ATP (a principal molécula de energia) está sendo consumido rapidamente e não está sendo reposto na mesma velocidade, provocando A Baixa Energia Celular (Estresse Metabólico).
Devido ao elevado consumo de ATP, ocorre acúmulo de ADP no citosol. Nessas condições, a adenilato cinase catalisa a conversão de duas moléculas de ADP em uma molécula de ATP e uma de AMP, amplificando o sinal de déficit energético da célula.
Como a adenilato Cinase e ativada pelo ADP?
A concentração do substrato, que pode ser ADP, AMP ou ATP, induz uma mudança na conformação da adenilato quinase, fazendo-a passar de uma forma aberta e inativa para uma forma fechada e cataliticamente ativa. Essa mudança conformacional é essencial para o processo, pois “aprisiona” os substratos no sítio ativo, alinhando os grupos químicos de forma otimizada para a transferência do fosfato.
quando o ADP se liga à cavidade da enzima adenilato quinase (ADK) que é formada pela interface dos domínios LID, NMP e CORE.
A enzima possui dois sítios de ligação distintos:
- O local de ligação do ATP, que é formado pelos domínios LID e CORE.
- O local de ligação do AMP, que é formado pelos domínios NMP e CORE.
Quando a adenilato quinase catalisa a reação de duas moléculas de ADP para formar ATP e AMP, os dois ADPs ligam-se simultaneamente a esses dois sítios, que ficam muito próximos um do outro em uma conformação fechada da enzima. A ligação do ADP induz uma mudança conformacional na enzima, de uma forma aberta para uma forma fechada, o que permite que a reação de transferência do grupo fosfato ocorra eficientemente. Tendo como resultado final uma molecula de ATP e uma molecula AMP.
OBS. 1 – Íons de Magnésio (Mg²⁺) é um cofator essencial, frequentemente se complexando com o ATP e o ADP para permitir a função catalítica da enzima.
OBS. 2 – a adenilato quinase não é ativada por um único “sinal de ativação”, mas sim pela presença de seus substratos e cofatores e pela necessidade de manter o equilíbrio energético da célula por meio de mudanças conformacionais e regulação alostérica.
Depois de todo esse processos, começa a almentar a concetração de AMP no citosol.
O verdadeiro objetivo da célula mamária cancerígena, na sua nova programação é a ativação da proteina AMPK.
O AMP se liga diretamente à subunidade regulatória da AMPK (Proteina quinase ativada por AMP). Ela estimula processos de catabolismo “quebra” de moléculas complexas em mais simples (como glicose, aminoácidos e ácidos graxos) liberando energia para o metabolismo da célula mamária.
A AMPK tambem promove a inibição de vias anabólicas, como a síntese de proteínas (via mTORC1), a síntese de ácidos graxos e a síntese de glicogênio, pois esses processos gastam muita energia que a célula não tem disponível no momento de estresse energético.
Os amigos já devem ter percebido uma contradição no funcionamento da célula mamária cancerígena, pois, mesmo com a concentração de ATP (energia) diminuída, a lipogênese (anabolismo) permanece ativada.
No próximo post, vamos explicar como a célula mamária cancerígena torna isso possível.
Veja todos os atigos “citados abaixo”
Referências:
Adenilato quinase e sinalização metabólica em células cancerígenas
https://pubmed.ncbi.nlm.nih.gov/32509571
A adenilato quinase 4 modula a resistência das células de câncer de mama ao tamoxifeno por meio de um mecanismo epitranscriptômico baseado em m6A
https://pubmed.ncbi.nlm.nih.gov/32956623
O papel da AMPK no metabolismo do câncer e seu impacto na imunomodulação do microambiente tumoral.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9975160
O estranho caso da AMPK e do câncer: Dr. Jekyll ou Mr. Hyde?
Proteína quinase ativada por AMP: um alvo terapêutico potencial para o câncer de mama triplo-negativo
https://link.springer.com/article/10.1186/s13058-019-1107-2
Amp- Proteína Quinase Ativada (AMPK): O Elo Proteico entre Metabolismo e Câncer
https://rmmg.org/artigo/detalhes/2725
O papel da AMPK no metabolismo do câncer e seu impacto na imunomodulação do microambiente tumoral.
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2023.1114582/full