Breast Cancer: AMPK and the Regulation of Glucose Uptake in Cellular Metabolic Reprogramming
Parte 12 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 09/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
O câncer de mama é a neoplasia maligna mais comum entre mulheres em todo o mundo e permanece associado a elevadas taxas de mortalidade, apesar dos avanços contínuos nas estratégias terapêuticas. A glicose desempenha papel muito importante no metabolismo das células tumorais, especialmente em função do efeito Warburg, que favorece a glicólise mesmo na presença de oxigênio. Nesse contexto, o transportador de glicose 4 (GLUT4) exerce um papel relevante na captação basal de glicose em linhagens de câncer de mama, como MCF-7 e MDA-MB-231. Onde a entrada de glicose nas células ocorre por meio de transportadores específicos da família GLUT e cuja expressão encontra-se aumentada no câncer de mama, juntamente com enzimas-chave do metabolismo glicolítico, estando ambas associadas ao prognóstico da doença. O câncer de mama triplo negativo (CMTN), é uma forma agressiva e de alto grau e apresenta uma dependência metabólica ainda mais acentuada da glicose no metabolismo.
Neste post, vou aborda o metabolismo da glicose no câncer de mama, com foco no GLUT4, cuja translocação pode ser indiretamente modulada pela AMPK como resposta adaptativa ao estresse energético. Ressalta-se que a entrada de glicose por intermédio inicialmente da AMPK, representa apenas um dos componentes necessários da reprogramação metabólica tumoral, sendo integrada a outros sinais regulatórios, como a insulina, que desempenha papel crucial nesse processo. Adicionalmente, destaca-se a elevada expressão do GLUT1 no câncer de mama, amplamente associada à progressão tumoral e ao desfecho clínico. Mais este post, vai aborda apenas a importância do transportador de glicose 4 (GLUT4), que desempenha um papel proeminente na captação basal de glicose em células de câncer de mama MCF7 e MDA-MB-231. Deixando evidenciado que a AMPK também têm influência no transportador de glicose 1 (GLUT1), que será detalhado em um outro post.
Palavras-chave: câncer de mama, metabolismo da glicose, AMPK, TBC1D1, transportador de glicose, GLUT4
Abstract
Breast cancer is the most common malignant neoplasm among women worldwide and remains associated with high mortality rates, despite continuous advances in therapeutic strategies. Glucose plays a very important role in the metabolism of tumor cells, especially due to the Warburg effect, which favors glycolysis even in the presence of oxygen. In this context, glucose transporter 4 (GLUT4) plays a relevant role in basal glucose uptake in breast cancer cell lines such as MCF-7 and MDA-MB-231. Glucose entry into cells occurs through specific transporters of the GLUT family, whose expression is increased in breast cancer, together with key enzymes of glycolytic metabolism, both of which are associated with disease prognosis. Triple-negative breast cancer (TNBC) is an aggressive, high-grade form of the disease and exhibits an even more pronounced metabolic dependence on glucose.
In this post, I address glucose metabolism in breast cancer, with a focus on GLUT4, whose translocation can be indirectly modulated by AMPK as an adaptive response to energetic stress. It is emphasized that glucose entry mediated initially by AMPK represents only one of the components required for tumor metabolic reprogramming, being integrated with other regulatory signals, such as insulin, which plays a crucial role in this process. Additionally, the high expression of GLUT1 in breast cancer is highlighted, being widely associated with tumor progression and clinical outcome. However, this post focuses exclusively on the importance of glucose transporter 4 (GLUT4), which plays a prominent role in basal glucose uptake in MCF-7 and MDA-MB-231 breast cancer cells. It is also made clear that AMPK influences glucose transporter 1 (GLUT1) as well, which will be detailed in another post.
Keywords: breast cancer; glucose metabolism; AMPK; TBC1D1; glucose transporter; GLUT4.
Introdução
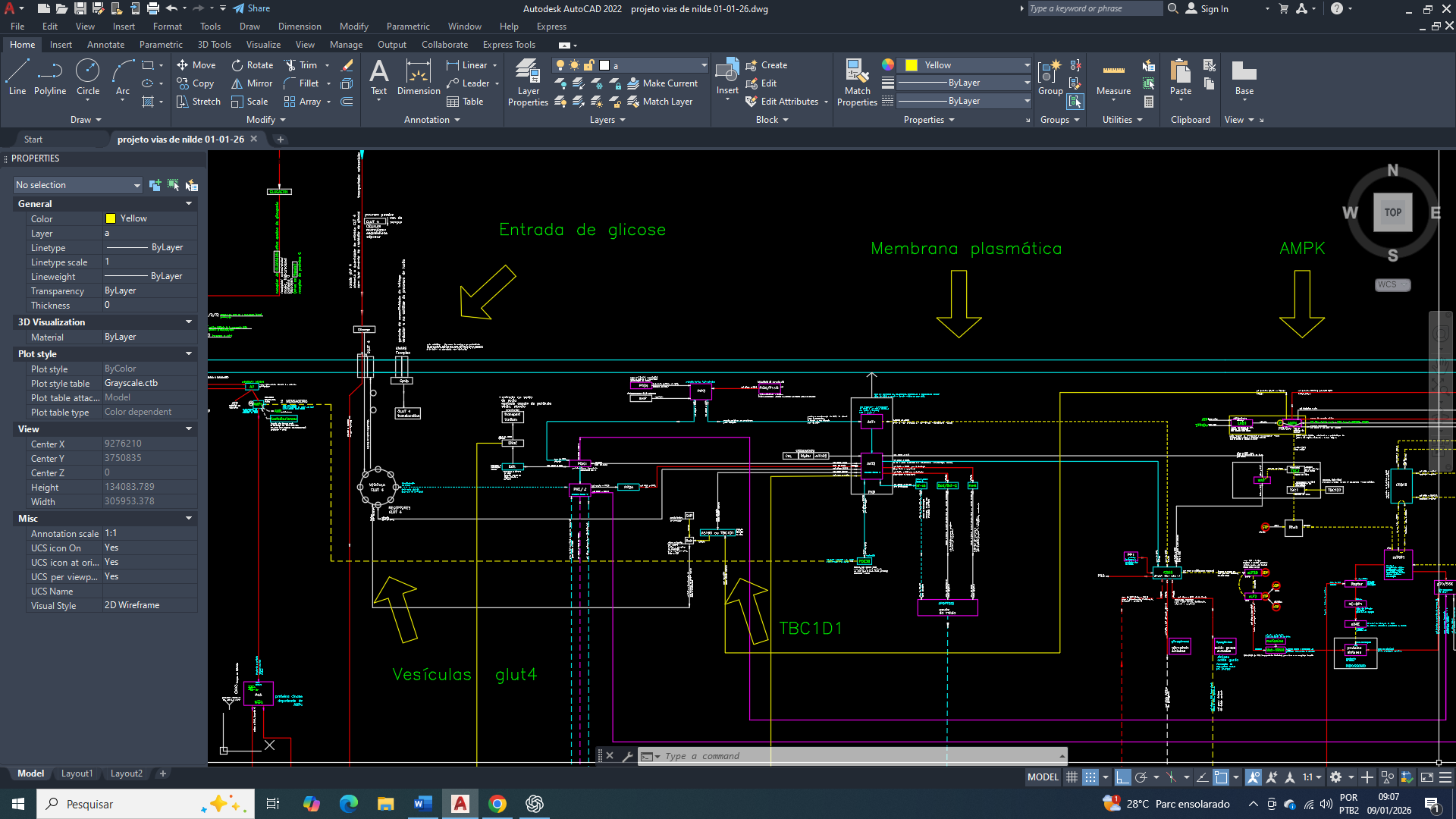
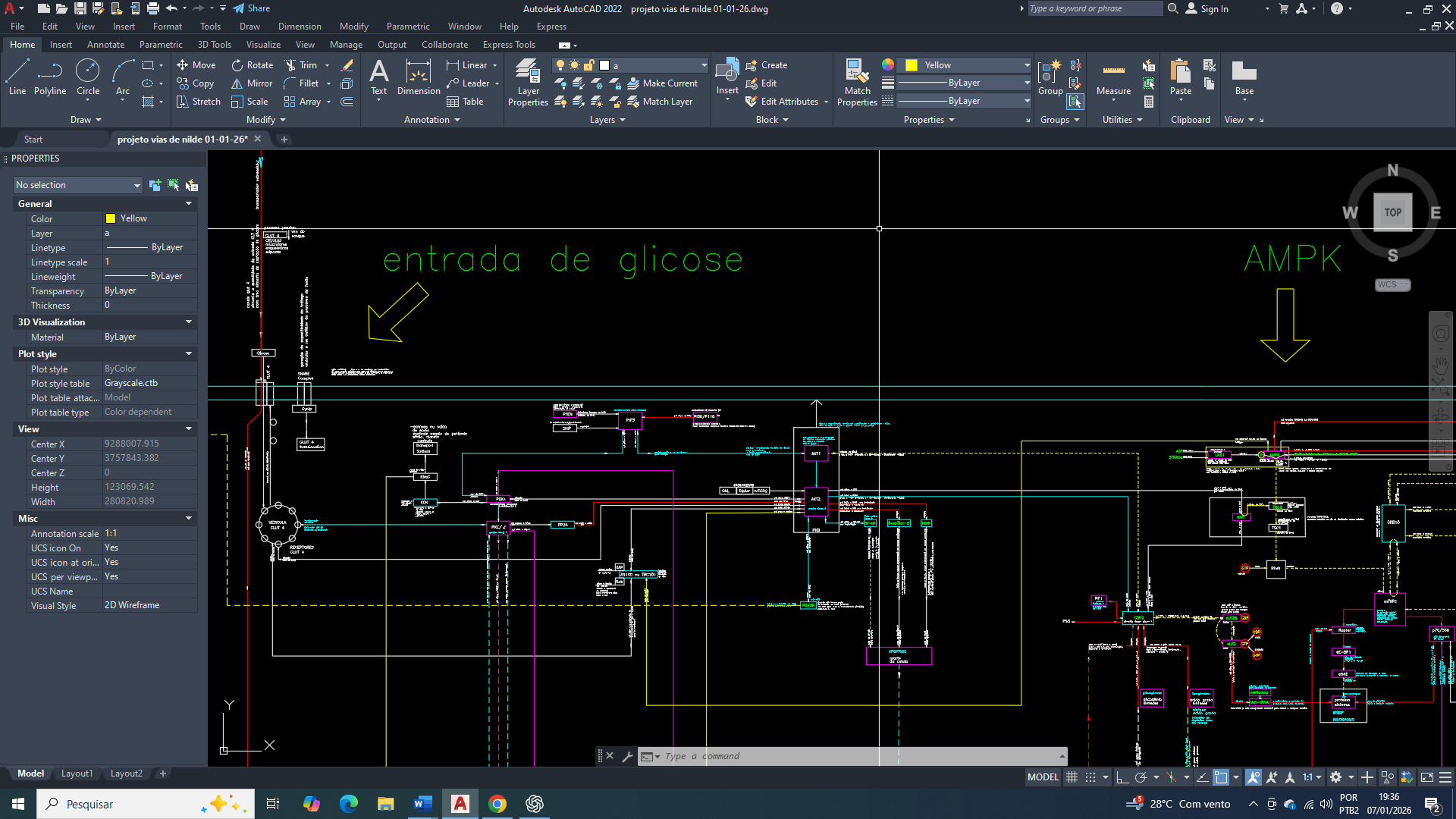
A ativação da AMPK estabelece uma relação funcional com a TBC1D1, associada ao aumento da entrada de glicose na célula, principalmente por meio da modulação da translocação de transportadores de glicose.
No câncer de mama, a AMPK atua como sensor de estresse energético, sendo ativada pelo aumento da razão AMP/ATP, geralmente decorrente de ineficiência mitocondrial crônica. Um dos alvos funcionais dessa ativação é a TBC1D1, uma Rab-GAP envolvida no controle do tráfego de transportadores de glicose.
A fosforilação da TBC1D1 pela AMPK reduz sua atividade inibitória sobre as proteínas Rab, permitindo a translocação de GLUT (principalmente GLUT4) para a membrana plasmática. Esse mecanismo aumenta a captação de glicose como resposta compensatória ao déficit energético, com o objetivo primário de restaurar níveis mínimos de ATP citosólico, e não de promover crescimento celular.
A ativação da AMPK também estimula o transporte de glicose mediado pelo GLUT1 através da ativação de transportadores de GLUT1 que (já são existentes na membrana plasmática), em vez de um aumento na translocação de novos transportadores a partir de estoques intracelulares (mecanismo mais comum para o GLUT4).
No contexto tumoral mamário, entretanto, essa via deixa de ser transitória e passa a operar de forma persistente, devido à manutenção contínua do estresse energético. Assim, o eixo AMPK–TBC1D1 contribui para a sustentação do fenótipo glicolítico, garantindo suprimento energético basal mesmo na ausência de eficiência mitocondrial adequada.
Importante destacar que, nesse cenário, a AMPK não reverte a reprogramação metabólica, mas atua como elemento adaptativo, permitindo a sobrevivência celular por meio da manutenção do fluxo de glicose via TBC1D1.
Resumo
No câncer de mama, a ativação crônica da AMPK promove a fosforilação da TBC1D1, facilitando a translocação de transportadores de glicose e sustentando a captação glicolítica como mecanismo adaptativo frente ao estresse energético persistente.
Entendendo a hierarquia de funcionamento da AMPK/TBC1D1/ RabGAP /GLUT4/ glicose
Ação direta da AMPK na fosforilação da TBC1D1 (AS160-like) para a entrada de glicose na célula.
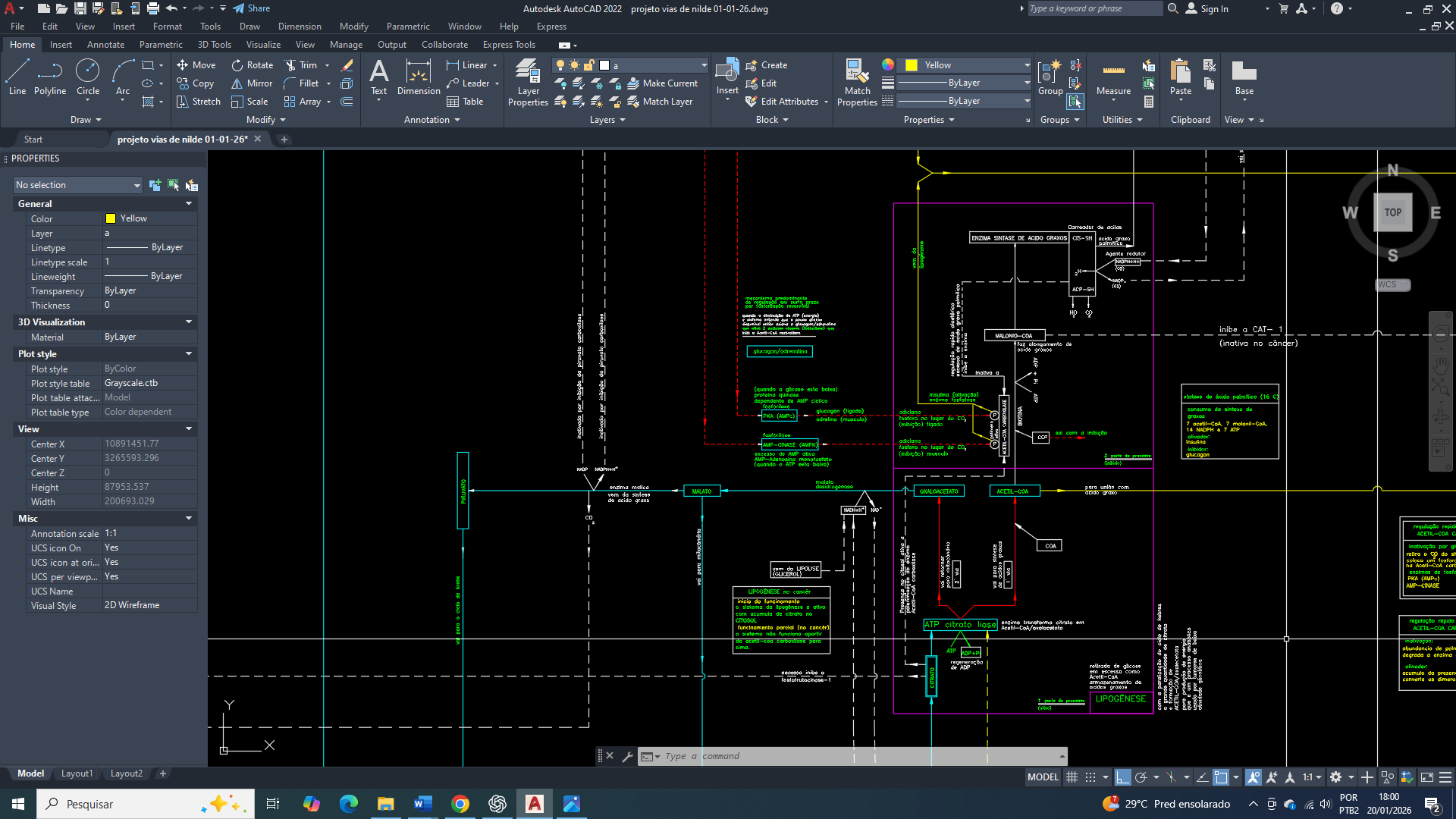
Quando a AMPK está ativa, uma de suas ações é a de uma fosforilação direta naTBC1D1 (especificamente a isoforma α1) em sítios distintos dos da insulina, sendo o mais caracterizado a Serina 237, Este local de fosforilação está localizado no segundo domínio de ligação à fosfotirosina (PTB2) da TBC1D1. Essa fosforilação acontece em sítios distintos dos da insulina na TBC1D1, isso produz o efeito de inibição da atividade GAP sobre a RabGAP (GTPase-activating protein), que por sua vez tem o efeito da translocação vesicular do GLUT4 para a membrana plasmática, tendo como resultado final o aumento da captação de glicose para a célula, de maneira independente da sinalização de insulina.
Obs. A fosforilação da TBC1D1 pela AMPK não estabelece, necessariamente, uma relação direta e estável com as proteínas 14-3-3 como um mecanismo primário nesse processo, mas sim favorecendo a atuação das 14-3-3 como proteínas adaptadoras (scaffolding), e não como agentes fosforiladores diretos do GLUT4. Essa característica já bem estabelecida na (literatura científica).
que indicam que a fosforilação da TBC1D1 na Ser237 pela AMPK pode até facilitar a ligação de proteínas 14-3-3; contudo, essa interação nem sempre envolve uma associação física direta ou estável entre AMPK com a TBC1D1, restringindo-se, ao reconhecimento transitório de substrato.
Bem amigos, além disso, a ligação das proteínas 14-3-3 em todo esse contexto deve ser interpretada como uma consequência regulatória da fosforilação, e não necessariamente como um evento que vai alterar diretamente a atividade Rab-GAP da TBC1D1. Também deve-se levar em consideração o fato de que múltiplos sítios de fosforilação, bem como mecanismos regulatórios adicionais, influenciam na função final da TBC1D1 para o controle do tráfego de transportadores de glicose.
O papel da insulina na entrada de glicose na célula de mama tumoral.
A insulina é o hormônio responsável por sinalizar para que a maioria das células do corpo (exceto neurônios e algumas outras) captem glicose da corrente sanguínea. As células cancerígenas de mama, devido ao seu metabolismo acelerado (efeito Warburg), têm uma demanda energética muito alta e, por isso, expressam mais receptores de insulina e transportadores de glicose (como o GLUT1 e GLUT2), tornando-as ávidas por glicose e responsivas à insulina.
A insulina além de regular a entrada de glicose na célula de mama, também atua como um hormônio de crescimento, estimulando a proliferação celular e inibindo a apoptose (morte celular programada). Através de vários estudos já é comprovado, que em células de câncer de mama, essa sinalização aumentada contribui diretamente para o crescimento do tumor. Embora a função da mesma tenha um papel diversificado na reprogramação metabolica da célula.
conclusão
Na célula mamária, a AMPK e a insulina regulam a entrada de glicose, mas por motivos fisiológicos distintos e com consequências metabólicas diferentes. Essa distinção é central para entender tanto o funcionamento de uma célula normal, quanto o funcionamento de uma célula mamária tumoral.
Meu Deus, não estabeleceria dois processos distintos, com funções próprias, sejam executados para um único objetivo final, pois isso contraria o princípio de eficiência e economia de energia. Ou seja, isso é desperdício de tempo e energia.
DEUS o pai, fez (Uma árvore bem fixada por uma raiz, com varia ramificações laterais).
Referências:
Metabolismo da glicose e transportadores de glicose no câncer de mama
https://pmc.ncbi.nlm.nih.gov/articles/PMC8450384
A perda de GLUT4 induz a reprogramação metabólica e prejudica a viabilidade das células de câncer de mama.
https://pubmed.ncbi.nlm.nih.gov/24931902
Domínio TBC
https://en.wikipedia.org/wiki/TBC_domain