Breast Cancer: Redefinition of Metabolic Priorities in Cellular Metabolic Reprogramming
Parte 10 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 07/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
Controle Energético, Sobrevivência e o Início de uma Adaptação Metabólica
O comprometimento crônico do ciclo de Krebs reduz de forma sustentada a geração mitocondrial de NADH e FADH₂, limitando o fluxo da cadeia respiratória e a capacidade de ressíntese de ATP por fosforilação oxidativa. A longo prazo, a demanda energética celular passa a exceder a capacidade de compensação metabólica, promovendo acúmulo de ADP e, por ação da adenilato quinase, elevação progressiva da concentração de AMP.
O aumento persistente de AMP mantém a AMPK em estado de ativação crônica, impondo um regime metabólico conservador que prioriza a sobrevivência imediata em detrimento da plasticidade metabólica. Nesse contexto, mesmo na presença de citrato citosólico suficiente para ocupar sítios alostéricos, a sinalização energética dominante limita a capacidade de expansão anabólica sustentada.
De modo análogo, na acetil-CoA carboxilase, a elevada disponibilidade de acetil-CoA não é suficiente para suplantar o controle energético imposto pela AMPK dentro de um desequilíbrio energético em curto prazo. Assim, a reprogramação metabólica torna-se apenas transitória, incapaz de se estabilizar a longo prazo, o que inviabiliza adaptações duradouras e restringe a seleção de fenótipos celulares metabolicamente mais eficientes.
Palavras-chave: Câncer-de-mama, reprogramação-do-metabolismo-celular, NADH, FADH₂, ATP, ADP, AMP, Adenilato-Cinase, AMPK.
Abstract
Chronic impairment of the Krebs cycle leads to a sustained reduction in mitochondrial NADH and FADH₂ generation, limiting respiratory chain flux and the capacity for ATP resynthesis through oxidative phosphorylation. Over time, cellular energy demand exceeds the capacity for metabolic compensation, promoting ADP accumulation and, through the action of adenylate kinase, a progressive increase in AMP concentration.
The persistent rise in AMP maintains AMPK in a state of chronic activation, imposing a conservative metabolic regime that prioritizes immediate survival at the expense of metabolic plasticity. In this context, even in the presence of sufficient cytosolic citrate to occupy allosteric sites, dominant energy signaling limits the capacity for sustained anabolic expansion.
Similarly, at the level of acetyl-CoA carboxylase, high acetyl-CoA availability is not sufficient to override the energy control imposed by AMPK under short-term energetic imbalance. Thus, metabolic reprogramming becomes merely transient, unable to stabilize over the long term, which prevents durable adaptations and restricts the selection of metabolically more efficient cellular phenotypes.
Keywords: Breast cancer; cellular metabolic reprogramming; NADH; FADH₂; ATP; ADP; AMP; adenylate kinase; AMPK.
Introdução
A Função (Ftorpedo), para manter a sobrevivência celular.
Esse arranjo metabólico constitui um mecanismo de proteção da sobrevivência da célula mamária, ao impor forte controle energético que limita a plasticidade metabólica e reduz a probabilidade de ocorrência de mutações genéticas, esse mecanismo, eu defino como função ftorpedo.
Quando a função de sobrevivência celular é implementada de forma integral e sustentada, ela deixa de atuar apenas como um mecanismo funcional transitório e passa a se estabelecer como um novo estado de equilíbrio metabólico, abrindo espaço para processos adaptativos.
Obs. (vicio produz consequências).
Contudo, quando o agente causal responsável pela disfunção metabólica persiste e mantém, a longo prazo, neste caso, uma baixa eficiência do ciclo de Krebs, o estado celular deixa de ser predominantemente conservador. A pressão energética crônica ultrapassa o limiar de contenção metabólica e esse contexto passa progressivamente de sobrevivência para adaptação. Nesse novo regime, a necessidade de manutenção funcional sob estresse contínuo favorece reprogramações mais profundas, as quais, por consequência, passam a influenciar processos de instabilidade genômica e como consequência, seleção de mutações genéticas.
Razão de equilíbrio entre ATP/ADP/AMP no metabolismo.
Uma concentração energética mínima pode, a longo prazo, manter o funcionamento basal do metabolismo celular. Porém, a sensibilidade operacional da adenilato quinase deve situar-se próxima a um estado energético intermediário, e não próxima do limiar mínimo. Porque Quando o sistema opera demasiadamente próximo do mínimo energético, o metabolismo torna-se muito vulnerável, uma vez que o consumo de ATP ocorre por demanda imediata em cada reação bioquímica solicitada.
Nesse contexto, pequenas flutuações negativas na disponibilidade de ATP resultam em acúmulo desproporcional de ADP e, por ação da adenilato quinase, em aumento progressivo da produção de AMP, tendo como padrão uma concentração maior que o normal. Assim, mesmo mantendo o metabolismo ativo, nesse contexto o sistema passa a sinalizar constantemente um ´déficit energético, promovendo uma ativação persistente de vias conservadoras e limitando a estabilidade metabólica a longo prazo.
A Origem dos Ajustes Metabólicos como Base para a Compreensão das Etapas Subsequentes
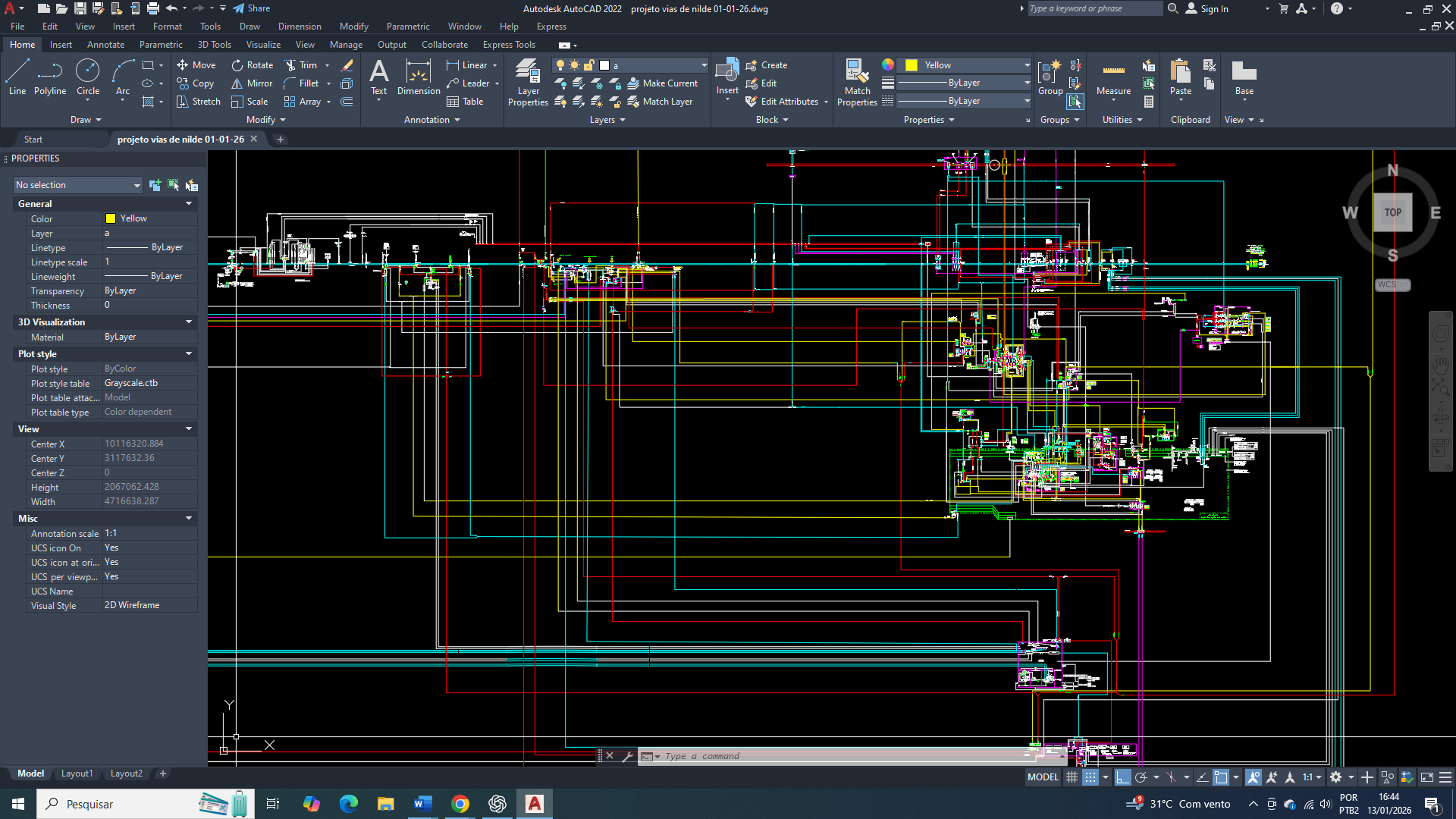
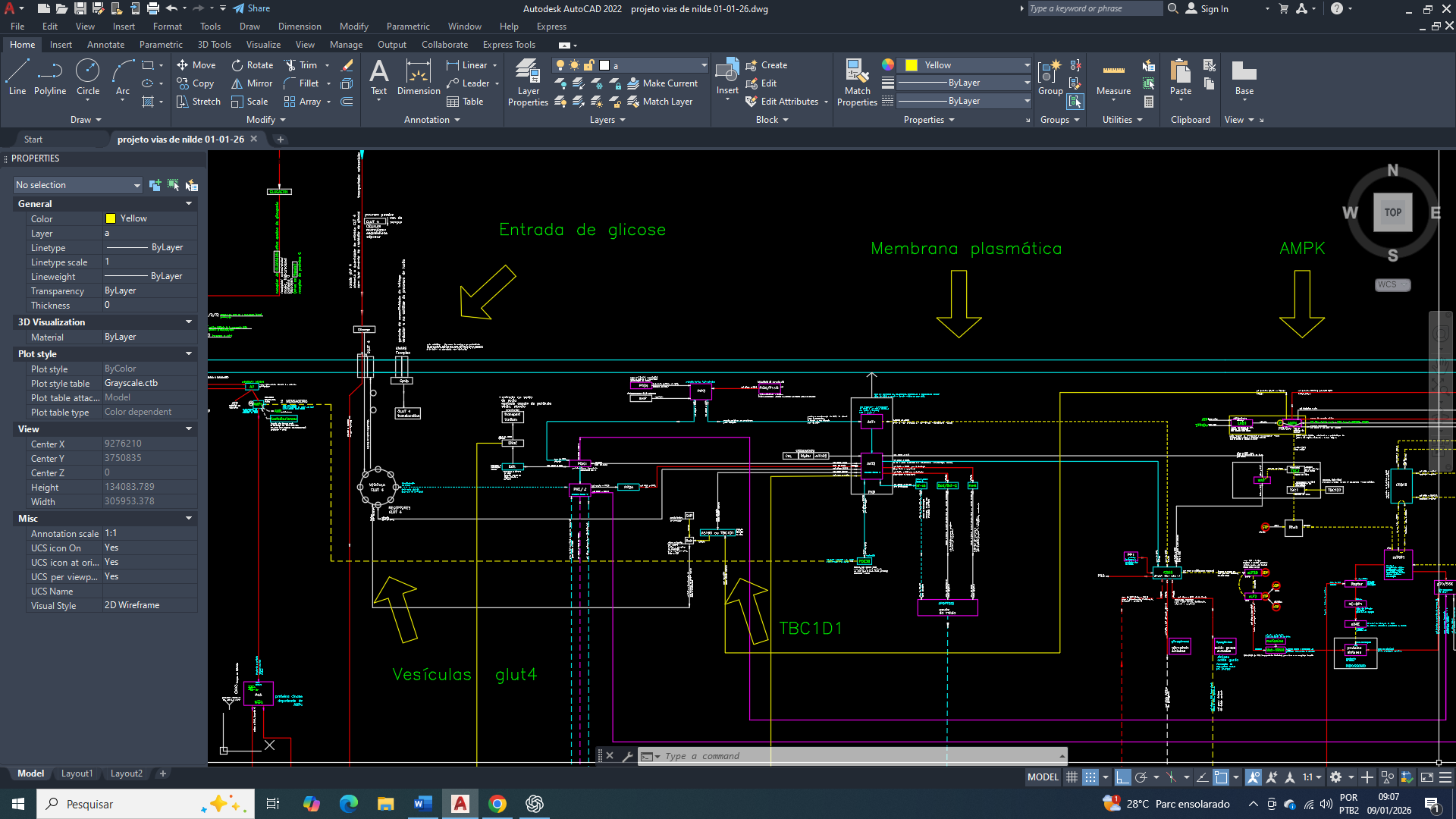
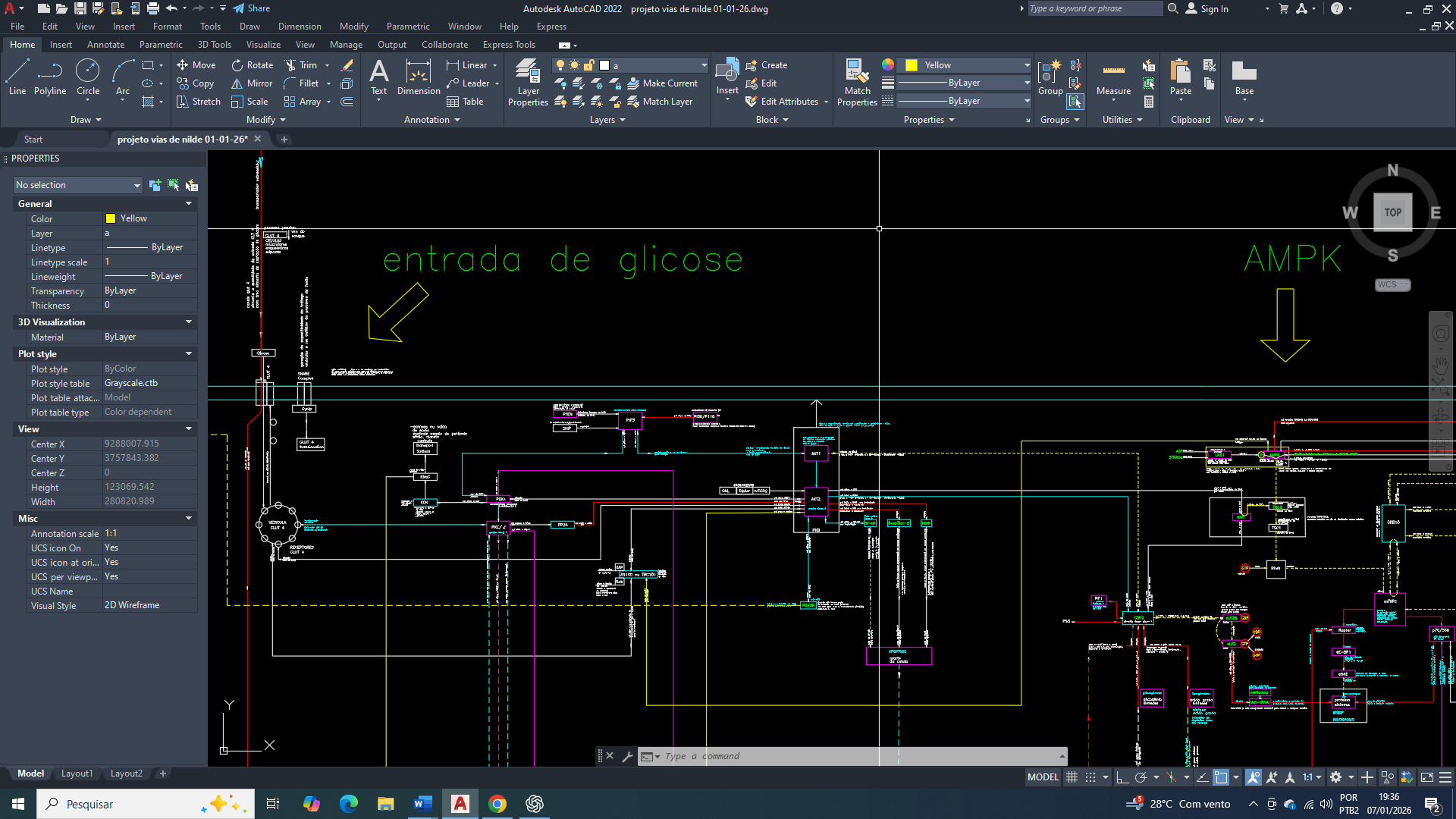
Tudo começa com o comprometimento funcional do ciclo de Krebs que estabelece o primeiro ponto de inflexão na organização metabólica celular, reduzindo de forma sustentada a produção mitocondrial de equivalentes redutores (NADH e FADH₂) e, consequentemente, a eficiência da fosforilação oxidativa. Essa limitação por consequência impõe restrição crônica à capacidade mitocondrial de ressíntese de ATP, criando um estado energético instável, ainda que seja compatível com a manutenção do metabolismo basal.
O ciclo de Krebs não sofre uma inibição total, mas parcial, principalmente ao nível da aconitase. Como resposta inicial, ocorre uma limitação do fluxo oxidativo. Posteriormente, o citrato mitocondrial passa a ser exportado para o citosol, onde assume um papel central na tentativa de reorganização metabólica, ao direcionar o excesso de acetil-CoA de origem mitocondrial para processos anabólicos no citosol. Esse sinaliza uma aparente disponibilidade de carbono, buscando evitar um colapso metabólico mitocondrial. Entretanto, esse deslocamento não restaura o balanço energético global, pois ele ocorre em um contexto de produção mitocondrial de ATP insuficiente.
A persistência da demanda energética celular promove um acúmulo de ADP no citosol e ativa de forma contínua a adenilato quinase, cuja ação amplifica pequenas variações negativas de ATP em aumentos desproporcionais da concentração de AMP. Esse aumento de AMP acima do seu estado fisiológico basal vai passa a representar o verdadeiro marcador do desequilíbrio energético crônico, mais sensível que a própria queda absoluta de ATP.
Primeiras consequências a longo prazo
Como consequência da inibição parcial do ciclo de Krebs, a uma elevação sustentada de AMP que resultará na ativação funcional da AMPK, que se estabelecerá como um dos eixos regulatórios dominantes no metabolismo tumoral. Sob esse controle, a célula adota um regime metabólico conservador, priorizando a geração rápida de ATP em detrimento da eficiência energética de longo prazo. Nesse cenário, ocorre o aumento da expressão e da atividade das enzimas regulatórias da glicólise, incluindo hexoquinase, fosfofrutoquinase-1 e piruvato quinase, consolidando a dependência do fluxo glicolítico citosólico como principal fonte energética (uma das principais características de uma célula tumoral).
Conclusão
A sequência linear iniciada pelo comprometimento do ciclo de Krebs culmina em um estado metabólico caracterizado por exportação de citrato, ativação da adenilato quinase, elevação crônica de AMP, ativação persistente da AMPK e superexpressão das enzimas regulatórias da glicólise. Esse arranjo não representa uma adaptação estável, mas um estado de vulnerabilidade metabólica sustentada, no qual a sobrevivência celular é mantida à custa de elevada sensibilidade a flutuações energéticas e limitação da plasticidade metabólica a longo prazo.
Ativação permanente da AMPK
Quando a razão ATP/ADP se mantém cronicamente próxima do limiar mínimo funcional, o sistema metabólico vai opera sob restrição energética contínua. Nessa condição, embora o ATP ainda seja suficiente para sustentar o metabolismo basal, pequenas variações negativas no suprimento energético resultam em acúmulo rápido de ADP. A adenilato quinase, atuando como amplificador do estado energético, converte esse excesso de ADP em AMP, deslocando a razão AMP/ATP para valores próximos de um estado intermediário, e não do mínimo absoluto.
A manutenção da concentração de AMP em níveis intermediários, deve ser acima do basal fisiológico, porém abaixo de colapso energético, para estabelecer um regime de controle refinado da sobrevivência celular. Esse estado vai permiti a ativação funcional e persistente da AMPK sem induzir falência metabólica, promovendo repressão seletiva de vias anabólicas dispendiosas e favorecendo a priorização de processos geradores rápidos de ATP.
Assim, a dissociação entre uma razão ATP/ADP próxima do mínimo e uma razão AMP/ATP situada em faixa intermediária cria um sistema metabolicamente ativo, porém rigidamente controlado, no qual a sobrevivência é mantida à custa de elevada vigilância energética. Esse arranjo não representa eficiência metabólica, mas sim um estado adaptativo de contenção, típico de células sob um estresse energético crônico, como observado no metabolismo tumoral.
Por que as células tumorais perdem a capacidade de desempenhar as funções especializadas?
Obs. (opinião de Fábio torpedo)
O novo contexto metabólico não elimina a célula, mas vai impor uma inibição seletiva de vias metabólicas associadas a funções especializadas, com o objetivo de economizar energia para priorizar a manutenção da sobrevivência celular. Nesse estado, vias que contribuem para funções metabólicas cooperativas do tecido são reprimidas em favor de processos mínimos e eficientes de geração de ATP.
conclusão
Células cancerígenas perdem sua função de especialidade tecidual, abandonando programas metabólicos e funcionais cooperativos, e passam a operar sob um regime voltado com prioridade a sua sobrevivência e à proliferação autônoma.
(Só Deus é Deus) Um homem que recusar uma verdade por incapacidade de compreendê-la, sempre se refugia em mentiras que jamais consegue justificar.
Referências:
Regulação metabólica das modificações epigenéticas e diferenciação celular no câncer
https://pubmed.ncbi.nlm.nih.gov/33339101
Metabolismo e carcinogênese do câncer
https://pubmed.ncbi.nlm.nih.gov/38287402
Metabolismo alterado no câncer: perspectivas sobre as vias energéticas e alvos terapêuticos.
https://pubmed.ncbi.nlm.nih.gov/39294640