Breast Cancer: Continuity of ATP Production Restoration in Cellular Metabolic Reprogramming
Parte 8 da série: Reprogramação Metabólica no Câncer de Mama
Fábio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 03/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
Na célula mamária tumoral, observa-se a predominância de um catabolismo intensamente expresso no citosol, voltado à rápida geração de intermediários metabólicos e equivalentes redutores, mais do que à produção eficiente de ATP. Paralelamente, o anabolismo apresenta elevada flexibilidade, permitindo o redirecionamento desses intermediários para múltiplas vias biossintéticas conforme a demanda celular. Essa dissociação funcional entre catabolismo citosólico ativo e anabolismo adaptativo sustenta a reprogramação metabólica tumoral, favorecendo proliferação, sobrevivência e adaptação a ambientes metabólicos instáveis.
A flexibilidade do anabolismo exerce papel central para amortecer as consequências da elevada expressão de substratos potencialmente indesejados no citosol, resultantes do catabolismo intensificado. Pois redireciona rapidamente esses metabólitos para vias biossintéticas, de armazenamento ou de reciclagem mantendo as concentrações de cada molecula dentro de niveis controlados, com isso a célula mamária tumoral evita desequilíbrios osmóticos, estresse redox e interferências na sinalização metabólica. Dessa forma, o anabolismo flexível não apenas sustenta a biossíntese necessária à proliferação, mas também atua como mecanismo de controle metabólico, preservando a viabilidade celular em um ambiente citosólico metabolicamente sobrecarregado.
Ou seja, tudo que é de mais e sobra e precisa ser descatado para não se acumular e tomar de conta da casa inteiramente. Mais em um ambiente descontrolado até isso traz péssimas consequências.
Palavras-chave: célula mamária tumoral; catabolismo citosólico; anabolismo flexível; plasticidade metabólica; homeostase metabólica.
Abstract
In tumor mammary cells, there is a predominance of an intensely expressed cytosolic catabolism, oriented toward the rapid generation of metabolic intermediates and reducing equivalents rather than efficient ATP production. In parallel, anabolism exhibits high flexibility, allowing the redirection of these intermediates into multiple biosynthetic pathways according to cellular demand. This functional dissociation between active cytosolic catabolism and adaptive anabolism sustains tumor metabolic reprogramming, favoring proliferation, survival, and adaptation to metabolically unstable environments.
The flexibility of anabolism plays a central role in buffering the consequences of the high expression of potentially undesirable substrates in the cytosol resulting from intensified catabolism. By rapidly redirecting these metabolites into biosynthetic, storage, or recycling pathways, their concentrations are maintained within controlled levels. Through this mechanism, tumor mammary cells avoid osmotic imbalance, redox stress, and interference with metabolic signaling. Thus, flexible anabolism not only supports the biosynthesis required for proliferation but also acts as a metabolic control mechanism, preserving cellular viability in a metabolically overloaded cytosolic environment.
In other words, anything that is in excess must be discarded so that it does not accumulate and take over the entire system. However, in an uncontrolled environment, even this process can lead to severe consequences.
Keywords: tumor mammary cell; cytosolic catabolism; flexible anabolism; metabolic plasticity; metabolic homeostasis.
Entrodução
A célula mamária, ao iniciar seu processo de adaptação metabólica, não vai opera de forma totalmente linear nem definitiva, mas por meio de uma sequência de objetivos funcionais que vão-se ajustado, interrompidos ou até mesmo revertidos conforme o contexto metabólico de cada momento. Durante o processo de reprogramação, cada objetivo concluído não vai representa um estado final, mas uma condição transitória, que é necessária para sustentar o próximo passo da reorganização metabólica.
Essa dinâmica sequencial e flexível tem como finalidade central a manutenção de um equilíbrio mínimo na produção de ATP, essa condição é indispensável para manter a sobrevivência celular durante fases de instabilidade metabólica. Nesse cenário, a célula vai priorizar mecanismos rápidos e acessíveis de geração de energia, mesmo que metabolicamente ineficientes, desde que capazes de sustentar a viabilidade celular.
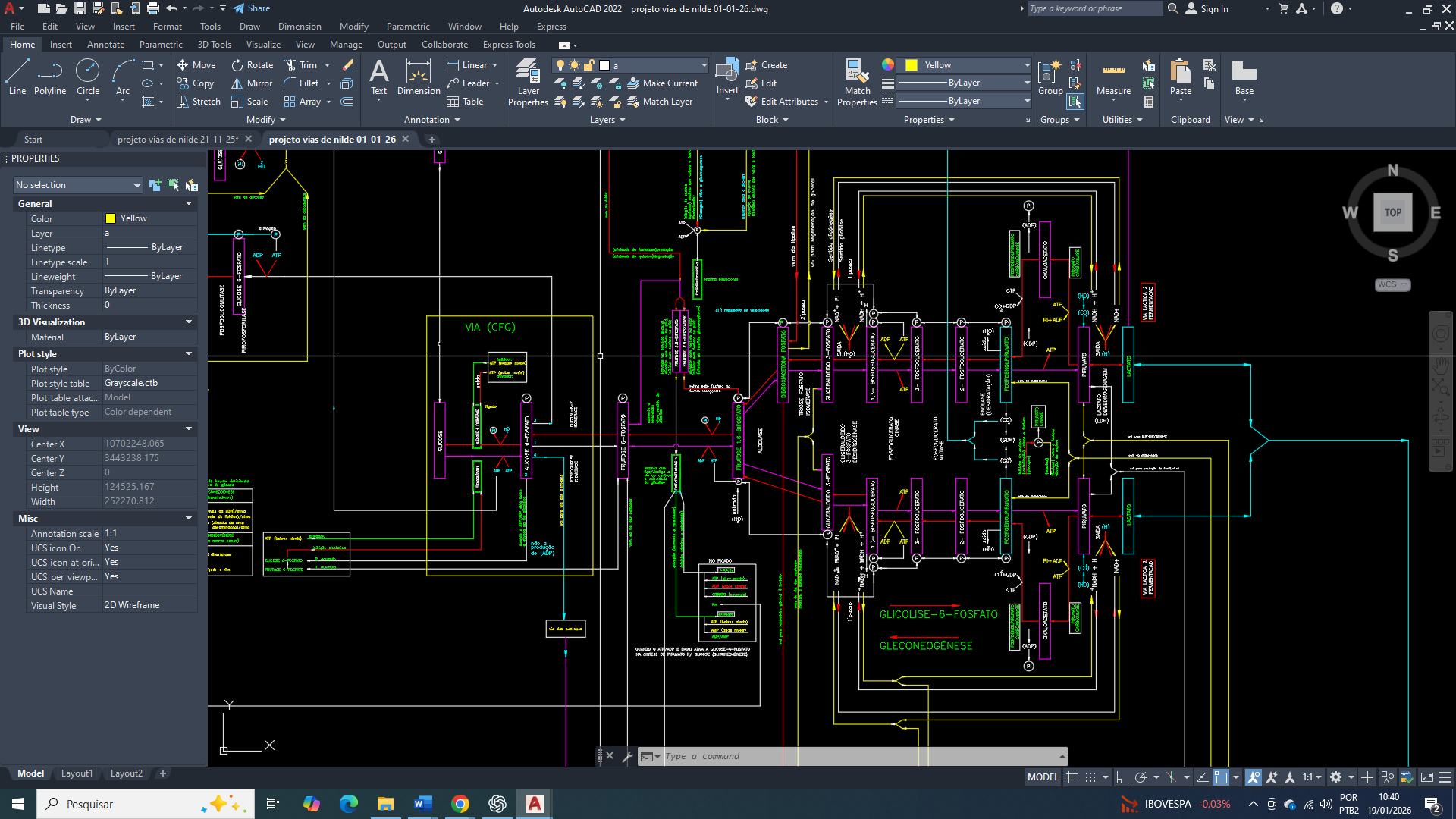
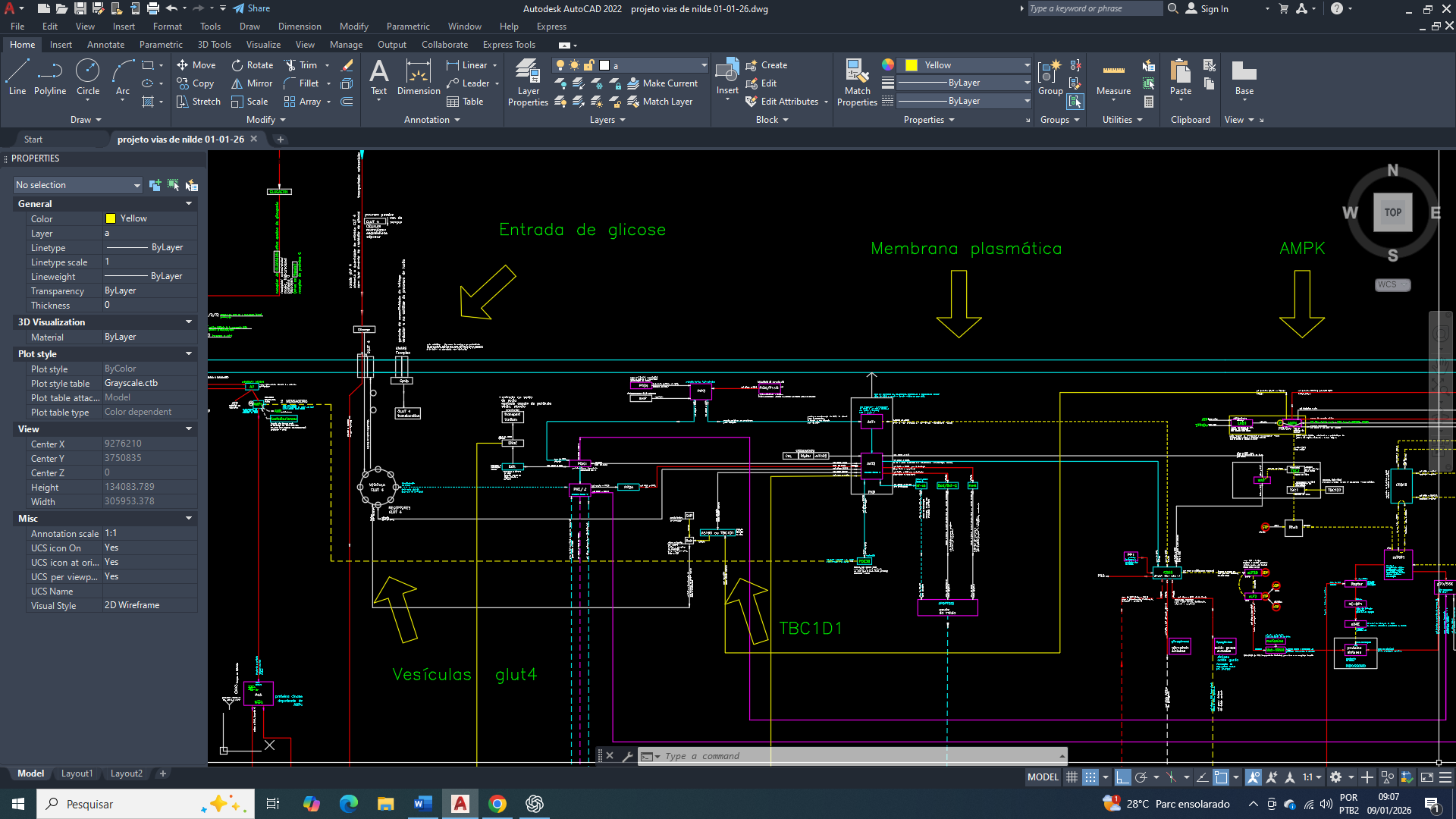
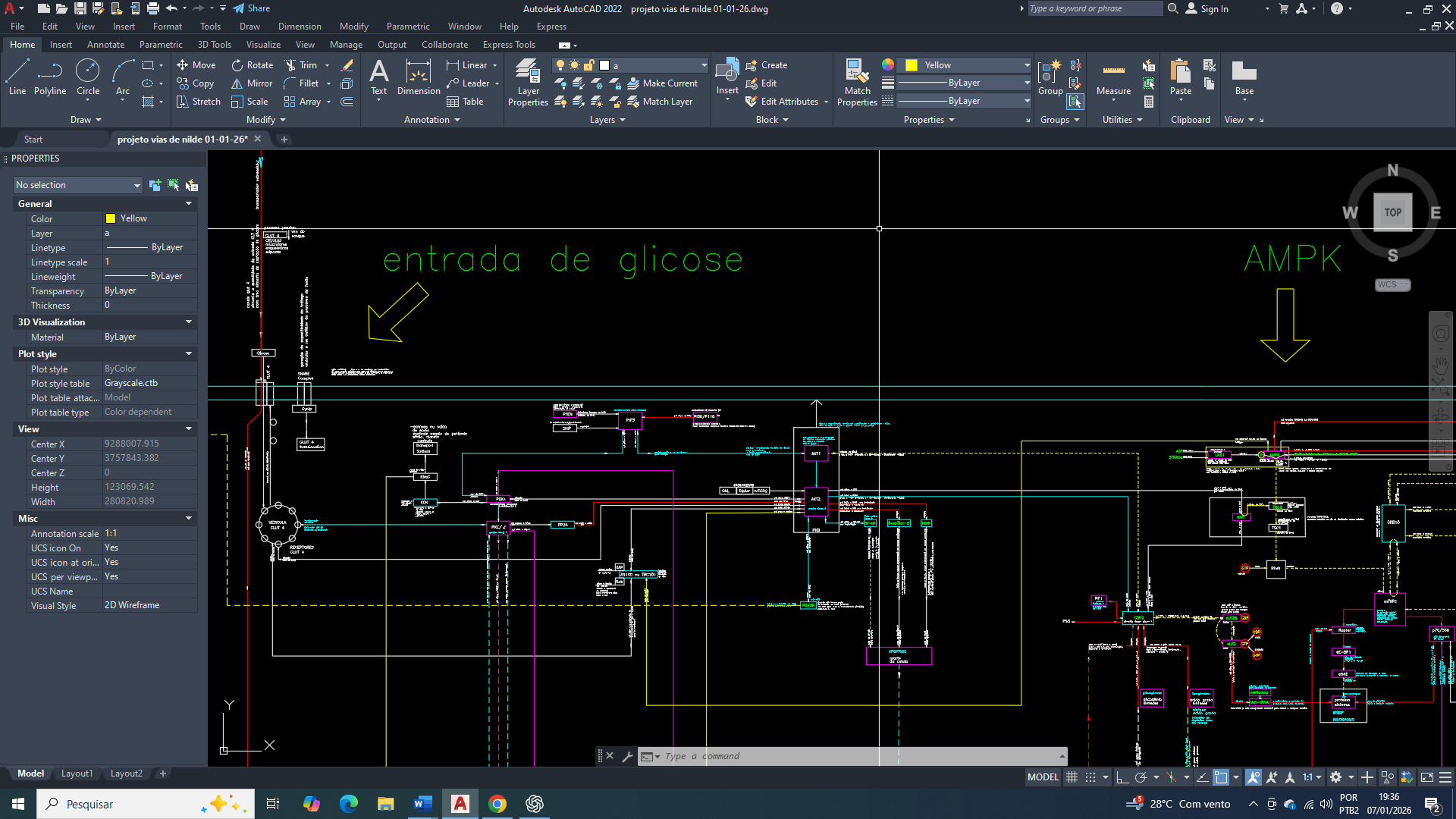
O primeiro desses objetivos consiste na ativação da lise da glicose com grande expressão no citosol, estabelecendo um eixo catabólico inicial permitindo uma rápida produção de ATP e de intermediários metabólicos. A partir desse ponto, a célula mamária passa a reorganizar suas vias metabólicas de forma progressiva, preparando o terreno para etapas subsequentes da sua reprogramação, sempre condicionadas ao estado energético e às demandas celulares do momento.
Embora, nas fases iniciais, o processo de adaptação metabólica não se estabeleça de forma estritamente linear ou definitiva, a sua organização metabólica resultante Sempre apresenta um caráter convergente. Mesmo que haja operações simultânea de múltiplas vias em paralelo, o metabolismo celular sempre direciona seus fluxos para pontos de bifurcação comuns, sejam de maneira direta ou indireta, conduzindo a um estado funcional final sempre compartilhado.
Ou seja, o metabolismo celular constitui um sistema completamente interligado, cuja compreensão não pode ser alcançada por meio de análises centradas em componentes ou vias isoladas, mas exige uma abordagem integrada do funcionamento metabólico como um todo.
(Não se pode entender o funcionamento de um motor estudando sobre um de seus parafusos).

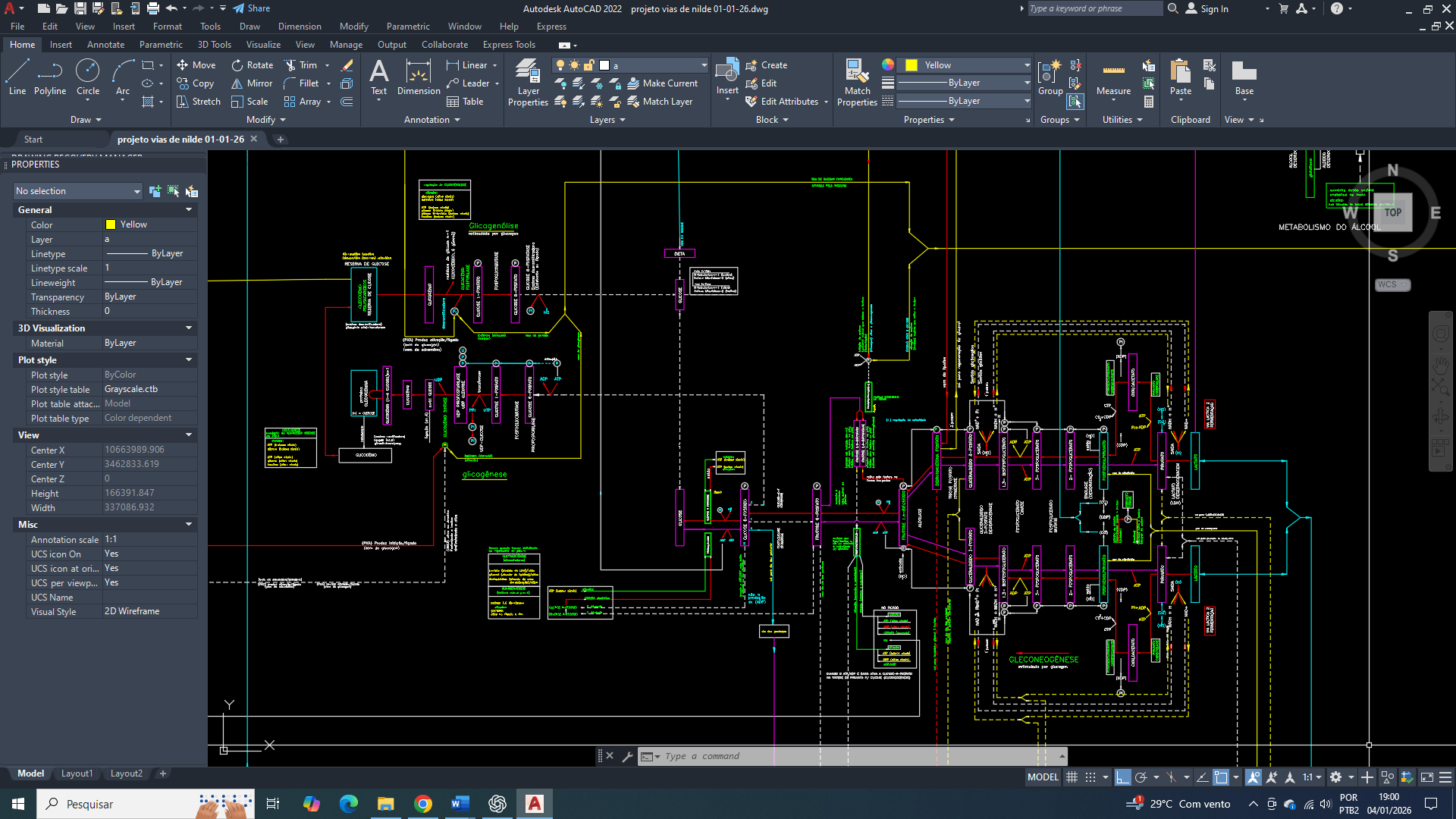
Integração mitocondrial do metabolismo energético envolvendo glicólise-6-fosfato e lipogênese.
Por que a glicose-6-fosfato constitui o primeiro ponto de ajuste na reprogramação metabólica celular?
Rapida Produção de energia para o citosol.
A redistribuição do citrato para o compartimento citosólico ocorre de forma regulada e funcional.
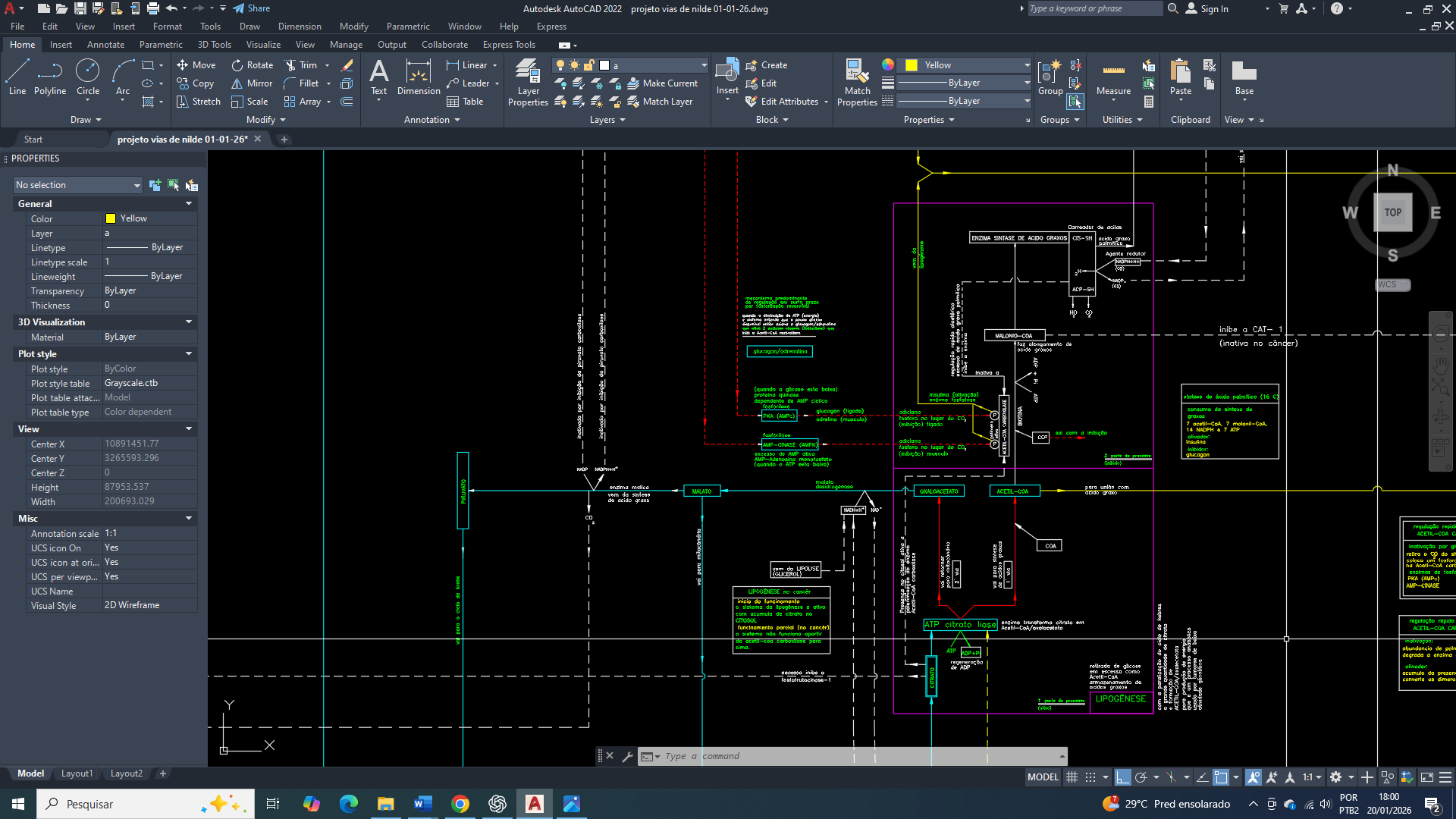
A presença de citrato no citosol exerce papel central na reorganização inicial do metabolismo da célula mamária, funcionando como um sinal integrador entre o estado energético mitocondrial e o metabolismo citosólico. O acúmulo citosólico de citrato, resultante de sua exportação da mitocôndria, indica abundância relativa de carbono e energia, mas, paradoxalmente, cria a necessidade de readequação do fluxo glicolítico.
Para que o citrato citosólico seja eficientemente convertido em acetil-CoA e direcionado à biossíntese lipídica, torna-se indispensável um suprimento contínuo de glicose-6-fosfato. Isso exige a ativação sustentada da glicólise, especialmente de seus passos iniciais, garantindo não apenas a manutenção do fluxo de carbono, mas também a regeneração de NAD⁺ e a produção de intermediários metabólicos compatíveis com as demandas anabólicas.
Além disso, o citrato citosólico impõe uma pressão metabólica que exige maior capacidade de amortecimento citosólico. A ativação da glicólise-6-fosfato contribui para esse ajuste ao permitir o rápido consumo de glicose, evitando acúmulo excessivo de substratos livres e favorecendo a redistribuição metabólica. Assim, a presença de citrato no citosol não atua apenas como produto do metabolismo mitocondrial, mas como elemento indutor da reorganização glicolítica, integrando catabolismo citosólico e anabolismo adaptativo na célula mamária tumoral.
Como isso é possível?
A ativação da glicólise-6-fosfato no citosol da célula mamária tumoral é primariamente determinada pela necessidade energética local, refletida pelas razões ATP/ADP e ATP/AMP, e não exclusivamente pela presença de metabólitos sinalizadores de abundância energética, como o citrato. Embora o citrato atue classicamente como inibidor alostérico de enzimas-chave da glicólise, especialmente da fosfofrutoquinase-1, esse mecanismo regulatório torna-se funcionalmente subordinado quando o citosol se encontra em estado de déficit energético relativo.
Em condições de elevada demanda citosólica por ATP, a rápida hidrólise de ATP e o consequente acúmulo de ADP e AMP promovem a ativação da fosfofrutoquinase-1 e de etapas iniciais da glicólise, reduzindo a sensibilidade da via à inibição exercida pelo citrato. Esse fenômeno decorre da integração hierárquica dos sinais metabólicos, na qual os indicadores diretos de carga energética citosólica possuem precedência funcional sobre sinais indiretos de abundância de carbono ou energia mitocondrial.
Além disso, na célula tumoral, a compartimentalização metabólica intensifica essa dissociação regulatória. O citrato citosólico, embora represente um sinal de disponibilidade de carbono, está frequentemente comprometido com rotas anabólicas, como a lipogênese, perdendo sua eficácia como regulador negativo da glicólise. Paralelamente, a ativação da glicólise atende não apenas à produção de ATP, mas também à manutenção do equilíbrio redox e ao fornecimento contínuo de intermediários metabólicos, funções essenciais que superam o controle alostérico clássico.
Dessa forma, a necessidade energética imediata no citosol impõe uma prioridade regulatória que sustenta a ativação glicolítica, mesmo na presença de citrato, evidenciando uma reprogramação funcional na qual os mecanismos de controle alostérico tradicionais são modulados ou parcialmente ignorados em favor da sobrevivência celular.
Determinantes Catalíticos e Alostéricos das Enzimas-Chave da Captação e Fosforilação da Glicose (CFG) e da Via da Glicose-6-Fosfato
A regulação da glicólise-6-fosfato é determinada por uma hierarquia funcional entre sinais que atuam nos sítios ativos e nos sítios alostéricos das enzimas regulatórias, sendo essa hierarquia fortemente condicionada pelo estado energético citosólico. Embora os moduladores alostéricos desempenhem papel central no ajuste fino do fluxo glicolítico, a ocupação e a atividade do sítio ativo permanecem prioritárias quando a célula enfrenta demanda energética imediata.
Nas principais enzimas regulatórias da Via de captação e fosforilação da glicose (CFG), na enzima hexoquinase e da via glicólise-6-fosfato nas enzimas fosfofrutoquinase-1 e piruvato quinase, os sítios alostéricos respondem a metabólitos que refletem o balanço energético global, como ATP, AMP, citrato e frutose-2,6-bisfosfato. Contudo, em condições de depleção energética, o aumento das concentrações de ADP e AMP favorece a estabilização conformacional das formas cataliticamente ativas dessas enzimas, reduzindo a eficácia dos sinais inibitórios alostéricos associados à abundância energética.
Essa prioridade funcional decorre do fato de que a ligação do substrato ao sítio ativo, associada à necessidade de reposição rápida de ATP, impõe um viés cinético favorável à progressão da reação, mesmo na presença de moduladores alostéricos negativos. Em particular, a PFK-1 apresenta um mecanismo regulatório no qual o AMP e a frutose-2,6-bisfosfato não apenas ativam a enzima, mas também antagonizam diretamente a inibição alostérica exercida por ATP e citrato, deslocando o equilíbrio conformacional para estados de alta afinidade pelo substrato.
Em contextos de reprogramação metabólica, como na célula mamária tumoral, essa hierarquia é ainda mais acentuada. A elevada demanda citosólica por ATP e intermediários metabólicos promove uma dominância funcional dos sinais associados ao sítio ativo e aos ativadores alostéricos positivos, enquanto os sinais clássicos de inibição tornam-se secundários. Assim, o controle da glicólise deixa de ser exclusivamente dependente da sinalização de abundância energética e passa a refletir a necessidade funcional imediata da célula.
Dessa forma, a prioridade regulatória entre sítios ativos e alostéricos não representa uma perda de controle metabólico, mas uma reorganização adaptativa que assegura a continuidade do fluxo glicolítico em condições de estresse energético, preservando a viabilidade celular.
porque o sítio ativo supera o sitio alosterico?
O ponto central é que ambos são solicitados simultaneamente, porém representam necessidades metabólicas distintas. Nessas condições, prevalece aquela que se impõe como necessidade principal para a manutenção do metabolismo celular.
O sítio ativo de uma enzima passa a superar funcionalmente o controle exercido pelo sítio alostérico quando a demanda metabólica imediata impõe prioridade à catálise em detrimento da modulação regulatória. Esse cenário ocorre, principalmente, em uma condição com um déficit energético citosólico, nas quais a uma necessidade de reposição rápida de ATP, isso vai elevar as concentrações de substratos e de cofatores ativadores e favorecerá uma ocupação contínua do sítio ativo das enzimas.
Nessas condições, o aumento de ADP e AMP, associados à redução da razão ATP/ADP, vai promover uma estabilização das conformações cataliticamente competentes das enzimas glicolíticas, especialmente da fosfofrutoquinase-1 (PFK-1). Esse efeito não vai apenas estimula a sua atividade catalítica, mas ela também reduz a eficácia dos inibidores alostéricos clássicos, como ATP e citrato, isso vai deslocar o equilíbrio conformacional da enzima para estados de alta afinidade pelo seu substrato.
Do ponto de vista cinético, uma elevada disponibilidade de seu substrato vai aumenta a probabilidade de ocupação do sítio ativo, elevando ao maximo a velocidade da reação independentemente da presença de moduladores alostéricos negativos. Assim, a regulação passa a ser dominada por fatores cinéticos e termodinâmicos locais, enquanto o controle alostérico assume papel de ação secundaria nesse contexto.
Em contextos de reprogramação metabólica, como na célula mamária tumoral, essa superação do controle alostérico pelo sítio ativo vai refletir em uma adaptação funcional. Onde a célula passa a priorizar a manutenção do fluxo glicolítico para sustentar a produção mínima de ATP, o equilíbrio redox e o fornecimento de intermediários metabólicos, mesmo que isso implique atenuar mecanismos regulatórios clássicos baseados em sinalização de abundância energética.
Conclusão
Com a superexpressão funcional do sítio ativo das enzimas regulatórias, a sobrevivência da célula mamária passa a ser sustentada pela descompatibilização da produção prioritária de ATP, que agora deixa de ser centralizada na mitocôndria e passa a depender majoritariamente da glicólise-6-fosfato no citosol.
(Na hora da fome o que interessa é a comida, todas as outras coisas ficam em segundo plano).
Outro ponto precisa ser ajustado
Entretanto, essa reorganização metabólica vai impor custos e consequências. Pois para manter o fluxo glicolítico necessário à produção mínima de ATP e ao fornecimento de intermediários metabólicos, torna-se indispensável o aumento da entrada de glicose na célula.
(Deus é o conhecimento)
Referências:
O papel do metabolismo da glicose reprogramado no câncer
https://www.mdpi.com/2218-1989/13/3/345
Mecanismos Metabólicos da Metástase do Câncer de Mama
https://www.frontiersin.org/journals/oncology/articles/10.3389/fonc.2020.602416/full
Glicólise no microambiente tumoral: um fator de progressão do câncer e um alvo terapêutico promissor