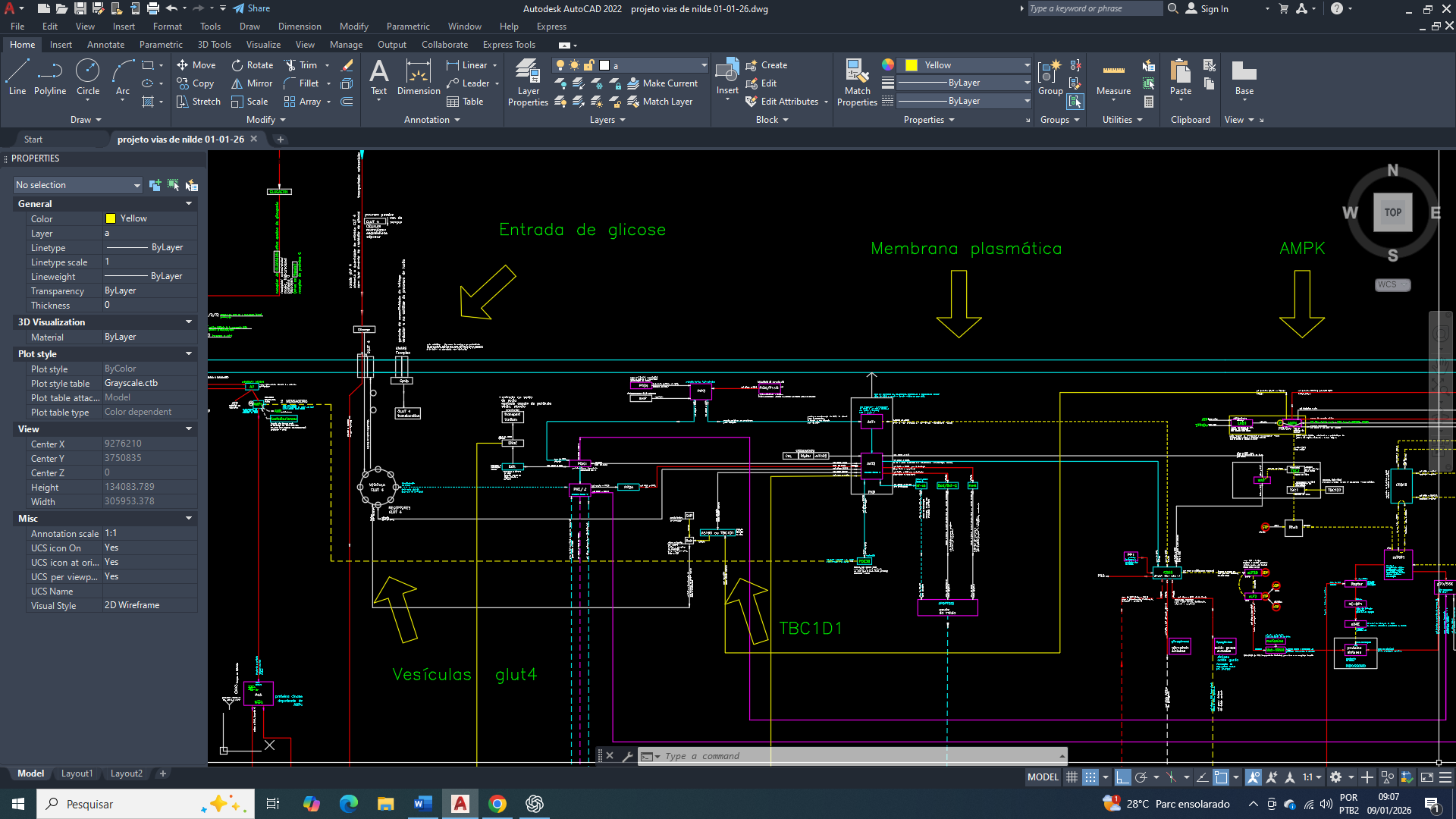
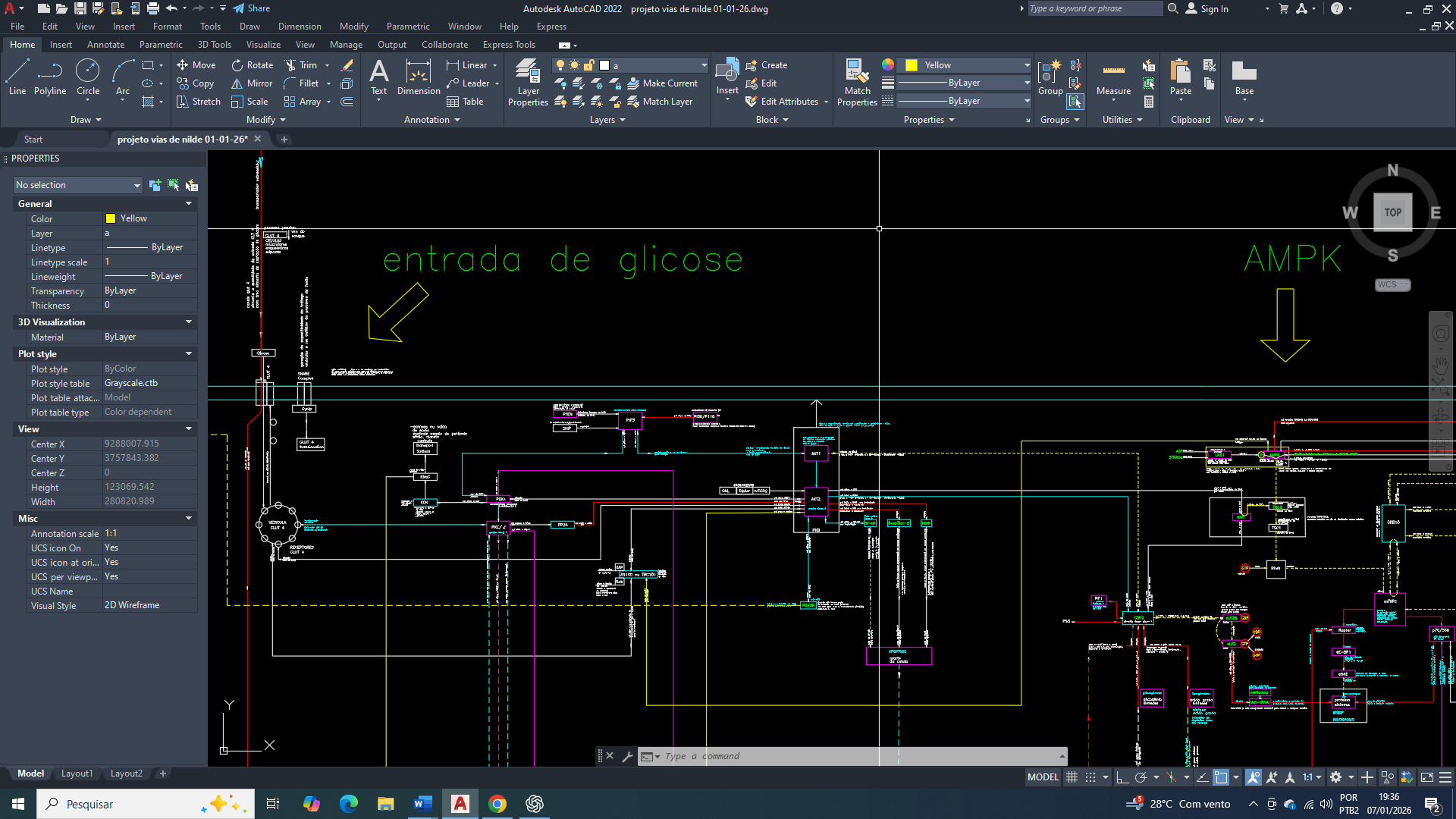
Breast Cancer: Restoration of ATP Production in the Continuity of Cellular Metabolic Reprogramming
Parte 7 da série: Reprogramação Metabólica no Câncer de Mama
Fábio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 02/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
Reprogramação metabólica diferenciada para produção de ATP.
Bem amigos, A sobrevivência da célula mamária, especialmente em contextos de estresse metabólico que se encontra, depende de uma manutenção de uma estabilidade energética mínima, definida pela capacidade de preservar níveis basais de ATP compatíveis com processos vitais essenciais no contexto que se encontra. Essa condição não implica alta eficiência bioenergética, mas sim uma programação diferencida para prevenção do colapso energético que levaria à falência celular.
Na célula de mama, a estabilidade energética é sustentada por mecanismos de homeostase adaptativa, que incluem a rápida detecção de quedas na razão ATP/ADP/AMP, a ativação de sensores energéticos citosólicos e mitocondriais e a reorganização do fluxo metabólico. Mesmo em situações de reprogramação metabólica, como ocorre na célula mamária tumoral, o objetivo primário inicial não é maximizar a produção de energia, mas garantir um fornecimento contínuo e mínimo de ATP para manutenção do potencial de membrana, funcionamento de bombas iônicas, integridade redox e viabilidade estrutural.
Essa estabilidade energética mínima é, portanto, um pré-requisito para qualquer reprogramação metabólica subsequente. Sem ela, a célula não vai conseguir sustentar a sinalização intracelular, a atividade enzimática básica nem os processos de adaptação que permitem a sua sobrevivência em microambientes desfavoráveis. Assim, a manutenção de um patamar energético basal representa o primeiro e mais crítico nível de controle metabólico na célula de mama, e vai funcionar como um eixo central entre a sua sobrevivência, adaptação e progressão funcional.
Palavras-chave: câncer de mama; reprogramação metabólica; Homeostase energética tumoral; Manutenção do ATP; Razão ATP/ADP/AMP; Sobrevivência celular.
Abstract
The survival of the mammary cell, especially under conditions of metabolic stress, depends on the maintenance of minimal energy stability, defined by the ability to preserve basal ATP levels compatible with essential vital processes in its current context. This condition does not imply high bioenergetic efficiency, but rather a differentiated metabolic programming aimed at preventing energetic collapse that would otherwise lead to cellular failure.
In the mammary cell, energy stability is sustained by adaptive homeostatic mechanisms, which include the rapid detection of decreases in the ATP/ADP/AMP ratio, activation of cytosolic and mitochondrial energy sensors, and reorganization of metabolic fluxes. Even in situations of metabolic reprogramming, as observed in tumor mammary cells, the initial primary objective is not to maximize energy production, but to ensure a continuous and minimal supply of ATP necessary for the maintenance of membrane potential, ion pump function, redox integrity, and structural viability.
This minimal energy stability is therefore a prerequisite for any subsequent metabolic reprogramming. Without it, the cell cannot sustain intracellular signaling, basic enzymatic activity, or adaptive processes that allow survival in unfavorable microenvironments. Thus, the maintenance of a basal energetic threshold represents the first and most critical level of metabolic control in the mammary cell, functioning as a central axis linking survival, adaptation, and functional progression.
Keywords: Breast cancer; metabolic reprogramming; tumor energy homeostasis; ATP maintenance; ATP/ADP/AMP ratio; cell survival.
Introdução
A célula de mama, assim como qualquer outra célula eucariótica, depende de um equilíbrio energético mínimo para poder manter sua viabilidade. Antes mesmo de processos complexos como a de proliferação, diferenciação ou de uma reprogramação metabólica, existe uma exigência que é fundamental (evitar o colapso energético). A manutenção de níveis basais de ATP constitui o alicerce sobre o qual todas as demais funções celulares serão sustentadas.
Em condições fisiológicas ou de estresse metabólico, a célula de mama vai ativa mecanismos de ajuste mais fino para uma homeostase energética, reorganizando fluxos metabólicos entre o citosol e a mitocôndria. Esse processo não tem como objetivo inicial maximizar a sua eficiência energética, mas sim de garantir uma estabilidade mínima, suficiente para preservar a sua integridade estrutural, o funcionamento de sistemas de transporte iônico, a sinalização intracelular e o controle redox, entre outros.
No contexto da reprogramação metabólica, especialmente relevante na célula mamária tumoral, essa estabilidade energética basal, vai representa o primeiro nível de adaptação celular. Sem ela, nenhuma reorganização metabólica posterior é possível. Assim, compreender como a célula de mama vai estabelecer e preserva esse patamar energético mínimo é essencial para poder entender tanto sua sobrevivência quanto os limites e vulnerabilidades associados à sua adaptação metabólica.
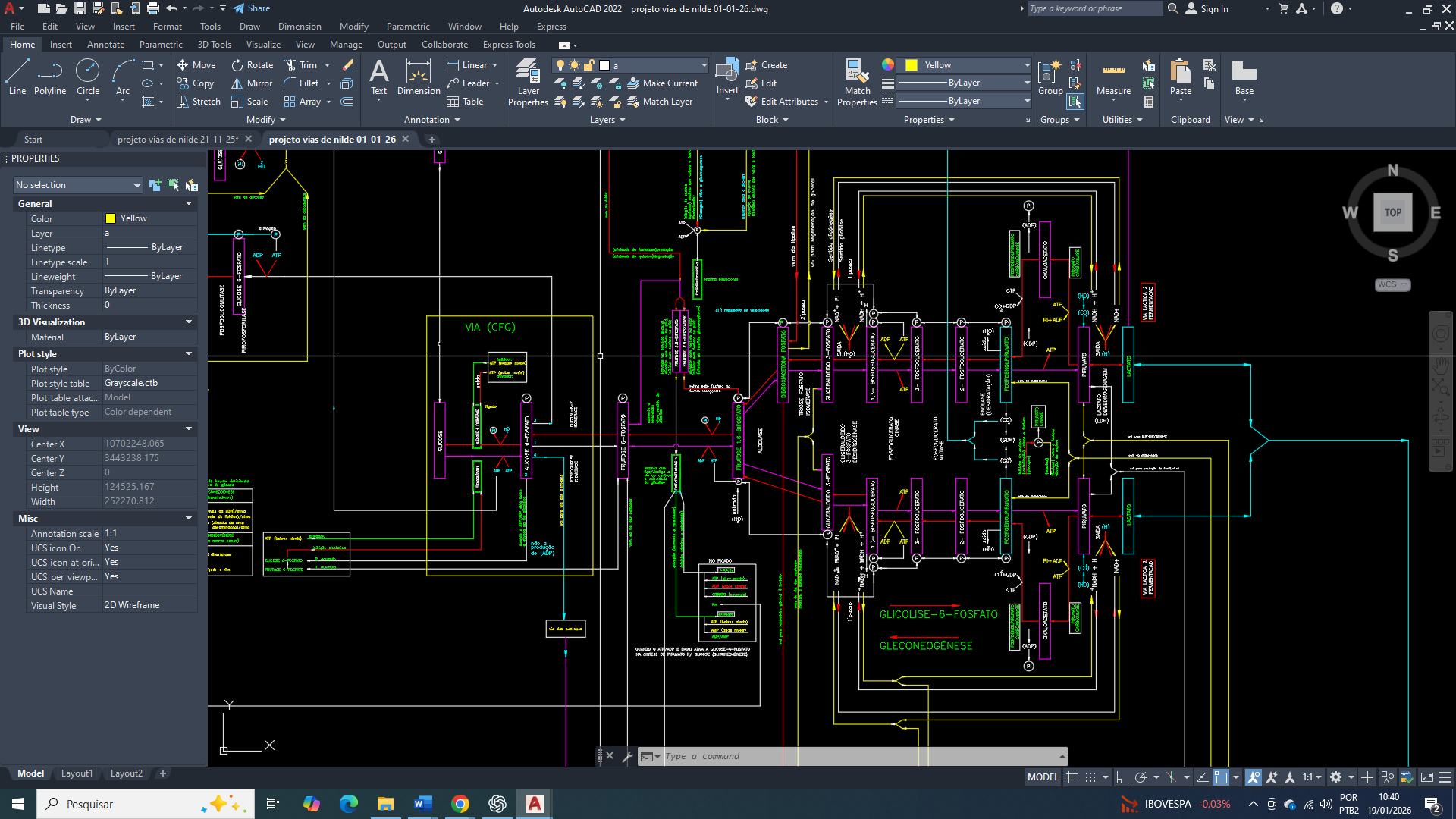
Produção de ATP
As células apresentam uma elevada flexibilidade metabólica; contudo, não são capazes de gerar novas vias metabólicas em curto prazo. A sua programação molecular permite apenas a adaptação e o redirecionamento de vias metabólicas pré-existentes, dentro de limites funcionais previamente estabelecidos (por DEUS).
Sendo assim, o ponto primário nesse contexto é identificar qual será a via metabólica que irá se adaptar para produzir ATP, substituindo (ainda que de forma parcial) a função primária do ciclo de Krebs.
conclusão:
Todas as vias metabólicas se adaptam ao contexto celular de forma cooperativa; entretanto, cada uma opera com expressão reduzida, contribuindo parcialmente para suprir a demanda energética mínima. Esse ajuste ocorre por meio de um catabolismo coordenado e de um anabolismo flexibilizado, priorizando a sobrevivência celular em detrimento da máxima eficiência metabólica.
Vias metabólicas que operam de forma integrada e interdependente.
No citosol:
– Glicólise (produção direta de ATP e NADH)
– Fermentação láctica (regeneração de NAD⁺)
Na mitocôndria:
– Oxidação do piruvato (formação de Acetil-CoA com produção de NADH)
– β-oxidação de ácidos graxos (produção de NADH e FADH₂)
– Oxidação de corpos cetônicos (cetólise, com produção de NADH e FADH₂, pelo ciclo de Krebs)
– Glutaminólise (geração de equivalentes redutores)
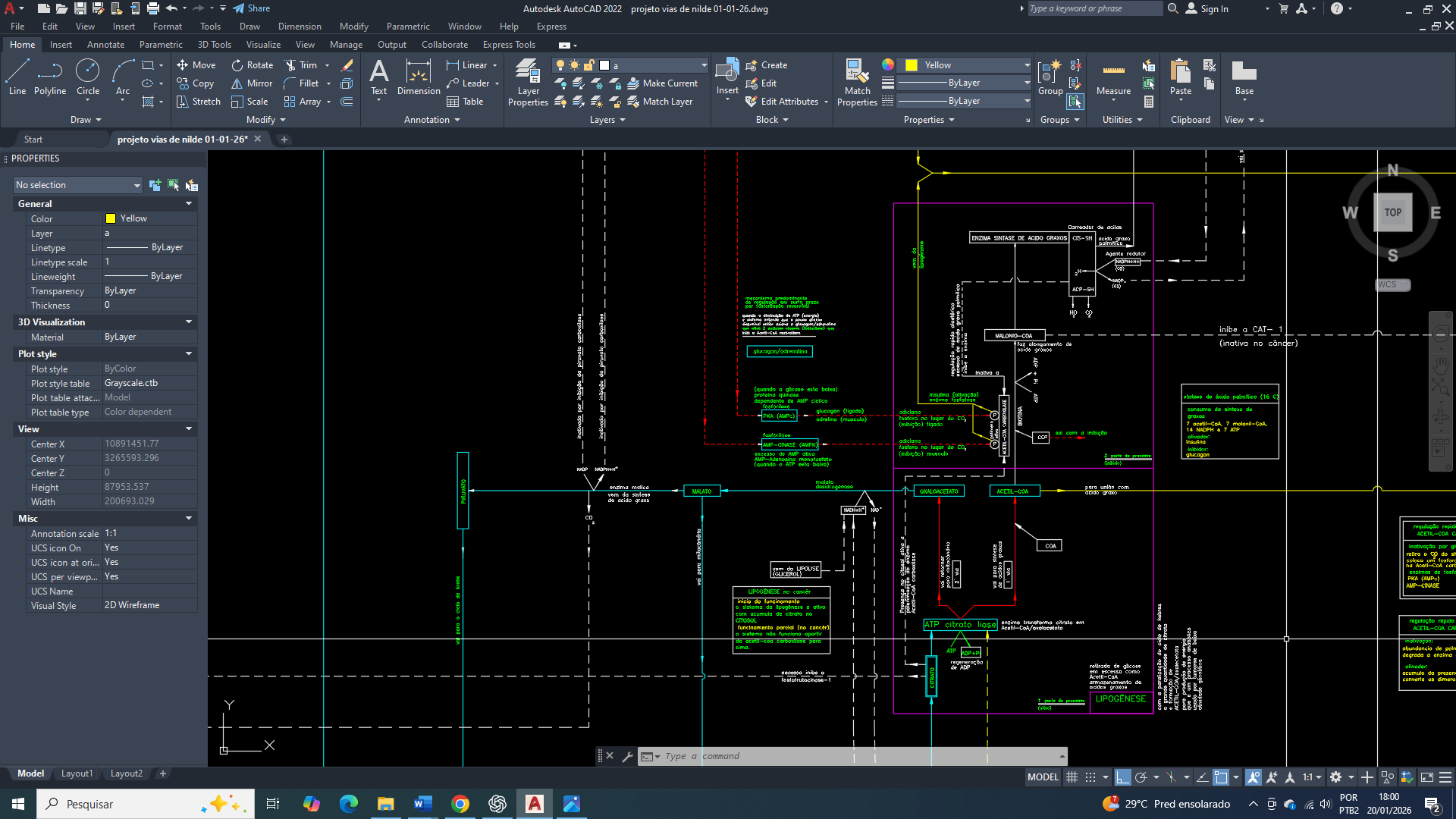
Iniciaremos pela via glicolítica (glicólise), especificamente pela via da glicose-6-fosfato.
Obs.: A hexoquinase não atua exclusivamente na glicólise. Sua função primária é adicionar um grupo fosfato à glicose, convertendo-a em glicose-6-fosfato. Esse processo aprisiona a glicose no interior da célula, uma vez que a glicose-6-fosfato não é capaz de atravessar a membrana plasmática.
O produto dessa reação, a glicose-6-fosfato, não está restrito à via glicolítica. Trata-se de um metabólito central, crucial para o metabolismo celular, que atua como ponto de ramificação para diversas vias metabólicas paralelas.
Dependendo das necessidades energéticas, biossintéticas e redox da célula, a glicose-6-fosfato pode ser direcionada para diferentes rotas metabólicas estratégicas, sustentando tanto processos catabólicos quanto anabólicos de forma flexível.
A expressão e a atividade da hexoquinase são moduladas por múltiplos mecanismos regulatórios, muitos dos quais independem diretamente da lise da glicose. Interpretá-la apenas como o primeiro passo da glicólise leva a diversas conclusões equivocadas sobre o funcionamento integrado do metabolismo celular.
A partir da glicose-6-fosfato, a célula de mama pode direcionar o metabolismo para diferentes vias, conforme suas demandas funcionais:
- Glicólise-6-fosfato:
A G6P é convertida em frutose-6-fosfato, prosseguindo na via glicolítica para produção de ATP por fosforilação em nível de substrato e geração de piruvato ou lactato, contribuindo para a estabilidade energética mínima.
- Via das pentoses fosfato (PPP):
A G6P pode ser desviada para a PPP, resultando na produção de NADPH, essencial para o controle do estresse oxidativo, manutenção do equilíbrio redox e suporte a processos biossintéticos, além da geração de ribose-5-fosfato para síntese de nucleotídeos.
- Glicogênese:
Em condições específicas, a G6P pode ser convertida em glicose-1-fosfato e direcionada para a síntese de glicogênio, funcionando como um reservatório energético transitório.
- Interconexão com vias anabólicas:
Por meio de intermediários derivados, a G6P contribui indiretamente para a síntese de aminoácidos, lipídios e nucleotídeos, refletindo a integração entre catabolismo e anabolismo de forma flexibilizada.
Dessa forma, a glicose-6-fosfato vai atua como um nó metabólico central, permitindo que a célula de mama ajuste dinamicamente seus fluxos metabólicos. Esse redirecionamento cooperativo para essas vias, garante não só uma máxima eficiência, mas também uma manutenção de grande viabilidade celular para permitir a sua estabilidade energética mínima, especialmente em um contexto de estresse ou de uma reprogramação metabólica em andamento.
Caracterização como um Nó Metabólico Central
Após a formação da glicose-6-fosfato, o fluxo de carbono pode ser direcionado para:
- Glicólise (produção de ATP)
- Via das pentoses fosfato (NADPH e ribose)
- Glicogênese (armazenamento energético)
- Interconexões anabólicas (síntese de lipídios, aminoácidos e nucleotídeos)
Assim, esse nó vai integrar a captação de glicose, uma sinalização energética diferenciada, um catabolismo e um anabolismo flexibilizado, essas caracteristicas são essências para permitir uma estabilidade energética mínima, para superar uma baixa eficiência do ciclo de krebs nas mitocôndrias da célula de mama.
Via de captação e fosforilação da glicose – (CFG)
A sobrevivência da célula de mama está condicionada, antes de qualquer especialização funcional ou reprogramação metabólica avançada, mais à uma manutenção de uma estabilidade energética mínima. Esse estado não depende de uma única via metabólica dominante, mas de uma cooperação coordenada entre múltiplas rotas metabólicas, que se ajustam dinamicamente conforme o contexto celular.
Nesse cenário, vias como a glicólise, a β-oxidação, a glutaminólise e os mecanismos mitocondriais de geração de equivalentes redutores vam atuar em forma integrada, com uma expressão modulada mais limitada, priorizando uma preservação do ATP basal. Paralelamente, o metabolismo organiza-se por meio de um catabolismo funcionalmente coordenado e de um anabolismo flexibilizado, garantindo viabilidade celular sem comprometer a sua integridade estrutural e redox.
A fosforilação da glicose, catalisada pela enzima hexoquinase, exemplifica esse princípio ao funcionar como um módulo metabólico central de distribuição, e não apenas como o início da glicólise. Sua regulação independente reforça que o metabolismo celular opera em rede, dentro de limites bem definidos e insuperáveis.
Assim, compreender a célula de mama a partir desse modelo integrado vai nos permite abandonar interpretações reducionistas e reconhecer que a adaptação metabólica não visa máxima eficiência, mas sim uma sustentação da vida celular dentro de um limiar energético mínimo, para permitir uma condição indispensável para qualquer processo adaptativo subsequente para a sua sobrevivência.
Ou seja. Meu Deus nos fez para viver para sempre.
Retornaremos ao item (via da glicólise – 6-fosfato).