Breast Cancer: Bioenergetic Comparison between the Glucose-6-Phosphate Pathway and the Mitochondria in Cellular Metabolic Reprogramming
Parte 15 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 17/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
O câncer de mama triplo negativo (TNBC) apresenta um fenótipo metabólico característico marcado por elevada dependência da glicólise-6-foafato, mesmo na presença de oxigênio, associada a uma eficiência mitocondrial funcionalmente comprometida. Evidências experimentais demonstram aumento consistente da captação de glicose, superexpressão de transportadores glicolíticos e ativação sustentada de enzimas da via glicolítica, resultando em produção elevada de lactato e remodelação do microambiente tumoral. Embora as mitocôndrias permaneçam estruturalmente presentes, sua capacidade oxidativa é frequentemente limitada por alterações na entrada de piruvato, desequilíbrios redox e restrições bioenergéticas impostas pelo alto fluxo glicolítico. Esse perfil metabólico não decorre de uma escolha adaptativa da célula tumoral, mas da convergência inevitável das redes bioquímicas para estados energeticamente viáveis diante das restrições físico-químicas e moleculares impostas ao sistema. Assim, a glicólise exacerbada no TNBC representa um estado funcional consolidado, posteriormente reforçado por alterações genéticas e epigenéticas.
Palavras-chave: câncer de Mama, Metabolismo-Celular, Reprogramação Metabólica, glicólise-6-fosfato, mitocôndria.
Abstract
Triple-negative breast cancer (TNBC) exhibits a characteristic metabolic phenotype marked by a high dependence on glycolysis–6-phosphate, even in the presence of oxygen, associated with functionally compromised mitochondrial efficiency. Experimental evidence demonstrates a consistent increase in glucose uptake, overexpression of glycolytic transporters, and sustained activation of enzymes of the glycolytic pathway, resulting in elevated lactate production and remodeling of the tumor microenvironment. Although mitochondria remain structurally present, their oxidative capacity is frequently limited by alterations in pyruvate entry, redox imbalances, and bioenergetic constraints imposed by the high glycolytic flux. This metabolic profile does not arise from an adaptive choice of the tumor cell, but from the inevitable convergence of biochemical networks toward energetically viable states under the physicochemical and molecular constraints imposed on the system. Thus, exacerbated glycolysis in TNBC represents a consolidated functional state, subsequently reinforced by genetic and epigenetic alterations.
Keywords: Breast cancer, Cellular metabolism, Metabolic reprogramming, Glycolysis-6-phosphate, Mitochondria.
Introdução
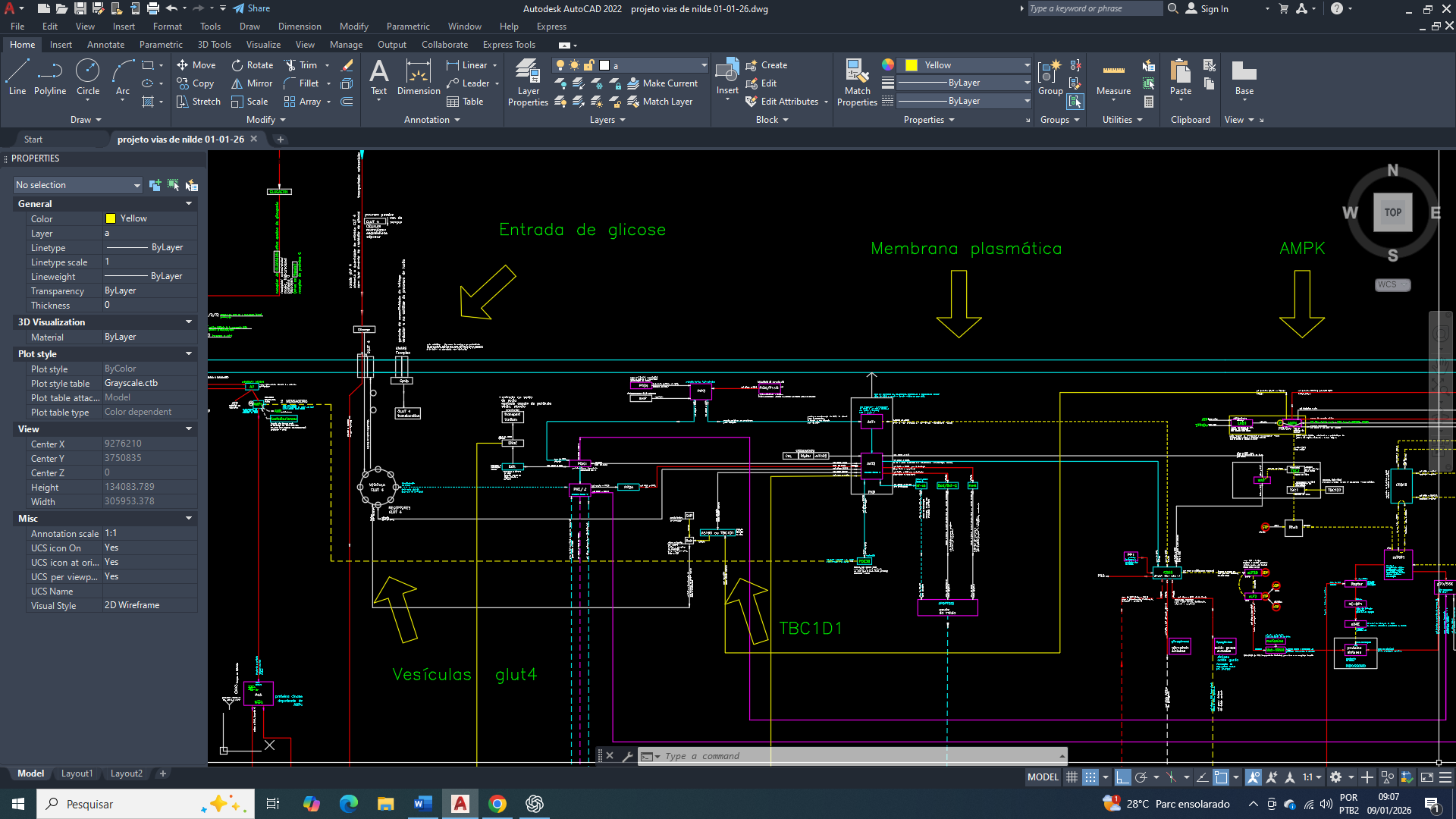
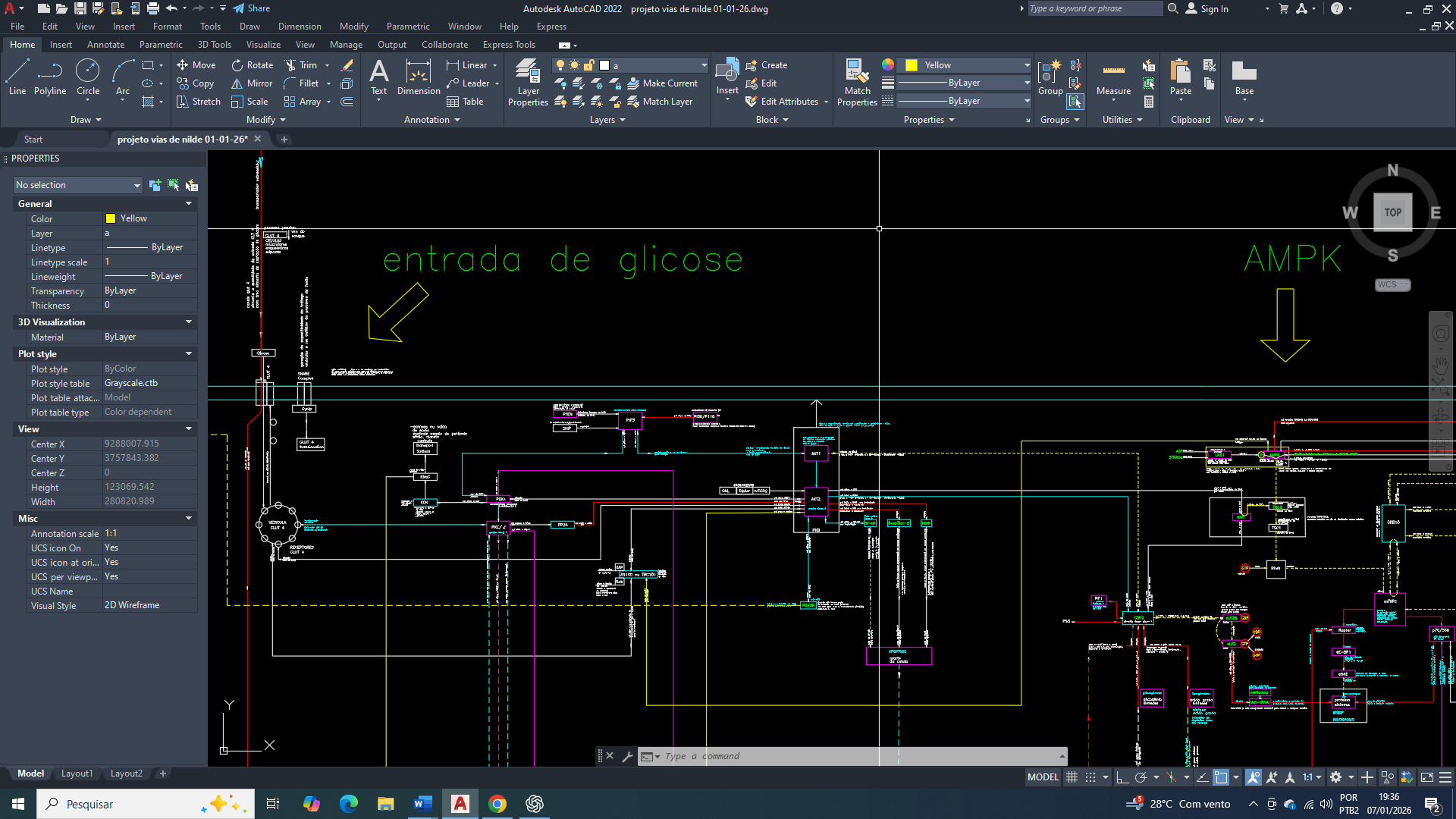
O câncer de mama triplo negativo é definido pela ausência de expressão dos receptores de estrogênio, progesterona e HER2, sendo clinicamente associado a maior agressividade e alta taxa proliferativa, propensão à metástase e opções terapêuticas limitadas. Paralelamente às suas características moleculares, o TNBC apresenta um perfil metabólico distinto, que é amplamente documentado, no qual a glicólise-6-fosfato aeróbica assume um papel central na manutenção energetica do metabolismo e da viabilidade tumoral.
Diversos estudos comprovam e demonstram que as células de TNBC, exibem aumento significativo da captação de glicose, sustentado por uma superexpressão de transportadores como GLUT1 e GLUT3, bem como pela ativação contínua de enzimas regulatórias da glicólise. Esse fluxo glicolítico elevado ocorre mesmo sob condições normóxicas e refletem em um redirecionamento do metabólico clássico para outro compatível com o efeito Warburg. Nesse novo sistema há uma consequência que se observa, como o acúmulo de lactato, acidificação do microambiente tumoral e suporte indireto a processos como invasão, evasão imune e resistência terapêutica.
Embora as mitocôndrias permaneçam presentes e metabolicamente ativas, a sua eficiência oxidativa no TNBC se encontra frequentemente com baixa qualidade funcional (em termos clássicos). Esse comprometimento não implica ausência funcional completa, mas resulta de restrições na oxidação do piruvato, alterações na razão NADH/NAD⁺, limitação do acoplamento fosforilativo e redirecionamento de intermediários metabólicos para vias biossintéticas. Dessa forma, a mitocôndria passa a desempenhar um papel secundário na geração de ATP, para manuteção energética do metabolismo, enquanto a glicólise-6-fosfato assume uma função dominante de sustentação energética e metabólica.
Nesse contexto, a reprogramação metabólica observada no TNBC não deve ser interpretada como uma adaptação deliberada, mas como a consequência direta das leis físico-químicas que governam o sistema celular. A convergência para um estado glicolítico dominante, sempre precede a consolidação genética e epigenética posterior e que posteriormente estabiliza esse fenótipo metabólico agressivo. Compreender essa hierarquia causal deve ser essencial para poder interpretar corretamente o metabolismo tumoral e identificar qual é são as vulnerabilidades terapêuticas carretas no câncer de mama triplo negativo.
Introdução
O câncer de mama triplo negativo é definido pela ausência de expressão dos receptores de estrogênio, progesterona e HER2, sendo clinicamente associado a maior agressividade, alta taxa proliferativa, propensão à metástase e opções terapêuticas limitadas. Paralelamente às suas características moleculares, o TNBC apresenta um perfil metabólico distinto, amplamente documentado, no qual a glicólise-6-fosfato aeróbica assume papel central na manutenção energética do metabolismo e da viabilidade tumoral.
Diversos estudos demonstram que células de TNBC exibem aumento significativo da captação de glicose, sustentado pela superexpressão de transportadores como GLUT1 e GLUT3, bem como pela ativação contínua de enzimas regulatórias da glicólise-6-fosfato. Esse fluxo glicolítico elevado ocorre mesmo sob condições normóxicas, refletindo um redirecionamento metabólico clássico, para outra programação compatível com o efeito Warburg. Nessa nova reprogramação observa-se Como consequência, um acúmulo de lactato, acidificação do microambiente tumoral e também suporte indireto a processos como invasão, evasão imune e uma alta resistência terapêutica.
Embora as mitocôndrias permaneçam presentes e metabolicamente sempre ativas, a sua eficiência oxidativa no TNBC encontra-se frequentemente comprometida. Esse comprometimento não implica em uma ausência funcional completa, mas resulta de restrições na oxidação do piruvato, alterações na razão NADH/NAD⁺, com uma limitação do acoplamento fosforilativo e um redirecionamento de intermediários metabólicos para vias biossintéticas. Dessa forma, em que a mitocôndria no cancer de mama, passa a desempenhar um papel secundário na geração de ATP, enquanto a glicólise-6-fosfato, assume a uma função totalmente dominante de sustentação energética e metabólica.
Devemos observar que nesse contexto, a reprogramação metabólica demostrada no TNBC não deve ser interpretada como uma adaptação deliberada, mas como a consequência que direta das leis físico-químicas que governam o sistema celular. A convergência para um estado glicolítico dominante que sempre precede a uma consolidação genética e epigenética posterior, que vai estabiliza esse fenótipo metabólico agressivo. Então compreender essa hierarquia causal é essencial para interpretar corretamente como é o funcionamento do metabolismo tumoral e também identificar onde fica suas vulnerabilidades terapêuticas reais no câncer de mama triplo negativo.
Paralelismo glicolítico versus capacidade mitocondrial na produção de ATP em células de câncer de mama
A produção de ATP nas células eucarióticas pode ser sustentada por dois sistemas metabolicamente distintos: a glicólise-6-fosfato citosólica, que opera de forma independente de oxigênio, e a fosforilação oxidativa mitocondrial, altamente eficiente, porém estrutural e redox-dependente. Embora a fosforilação oxidativa apresente rendimento energético muito superior por molécula de glicose, a glicólise-6-fosfato distingue-se por ter uma elevada capacidade de paralelização, permitindo que milhares de vias funcionem simultaneamente no citosol.
Também devemos considerar que a glicólise-6-fosfato não constitui uma via única, mas sim um conjunto massivo de unidades enzimáticas paralelas. Em células mamárias tumorais, estimativas baseadas na abundância de enzimas glicolíticas como hexoquinase 2 (HK2) da via (VFG)- via de fosforilação da glicose e as enzimas fosfofrutoquinase-1 (PFK1), PFKFB3 e gliceraldeído-3-fosfato desidrogenase (GAPDH) da via glicolise-6-fosfato, que indicam a presença funcional de aproximadamente 10⁴ a 10⁵ vias glicolíticas ativas por célula. Esse elevado número é sustentado por superexpressão de transportadores de glicose, particularmente GLUT1 e GLUT3, que garantem um fluxo contínuo de substrato mesmo em condições de glicose limitada no microambiente tumoral.
Em contraste, a produção mitocondrial de ATP depende do número de mitocôndrias funcionais por célula, tipicamente entre 1.000 e 2.000 em células normais e frequentemente reduzido para 300 a 1.000 em células tumorais agressivas. Cada mitocôndria contém múltiplas cadeias respiratórias paralelas, com milhares de complexos da cadeia de transporte de elétrons, sendo capaz de produzir em média cerca de 10⁴ moléculas de ATP por segundo em condições ideais. Quando considerada em escala celular, a fosforilação oxidativa apresenta uma capacidade total de produção de ATP da ordem de 10⁷ a 10⁸ moléculas por segundo em células normais, superando amplamente a eficiência da glicólise fermentativa.
No entanto, essa superioridade mitocondrial é condicionada à integridade estrutural da organela, à manutenção do potencial de membrana mitocondrial (ΔΨm), à disponibilidade de oxigênio e ao controle do estresse oxidativo. Em tumores de mama, especialmente nos subtipos triplo-negativo e HER2-positivo, com uma disfunção mitocondrial parcial, a hipóxia intermitente e o aumento da produção de espécies reativas de oxigênio comprometem a estabilidade da fosforilação oxidativa, reduzindo sua capacidade de acompanhar a demanda energética imposta pela proliferação rápida e pela migração celular.
Nesse contexto, a glicólise fermentativa emerge como uma estratégia bioenergética robusta, não por sua eficiência, mas por sua redundância estrutural e flexibilidade funcional. Embora cada via glicolítica gere apenas 2 moléculas de ATP por glicose, a operação simultânea de dezenas de milhares de vias permite que a taxa global de produção de ATP alcance os valores da ordem de 10⁶ a 10⁷ moléculas por segundo por célula, aproximando-se da produção mitocondrial em células tumorais metabolicamente comprometidas. Além disso, a produção de ATP glicolítico ocorre de forma altamente localizada no citosol, favorecendo processos como remodelamento do citoesqueleto, formação de lamelipódios e manutenção de gradientes iônicos essenciais para uma migração e invasão.
A ativação crônica da AMPK em resposta a flutuações energéticas e ao aumento da razão AMP/ATP reforça esse fenótipo metabólico, promovendo a expressão de GLUT3 e enzimas glicolíticas, ao mesmo tempo em que reduz a dependência da mitocôndria como reguladora central da apoptose. Esse rearranjo metabólico sustenta a sobrevivência celular em ambientes hostis, porém ocorre à custa de acidificação do microambiente tumoral, instabilidade redox e aumento da pressão mutagênica, fatores que contribuem para progressão tumoral e metástase.
Assim, enquanto a fosforilação oxidativa mitocondrial pode ser comparada a poucos geradores altamente eficientes, a glicólise fermentativa funciona como milhares de geradores menores operando em paralelo. Em células de câncer de mama, essa assimetria estrutural confere à glicólise-6-fosfato uma vantagem adaptativa decisiva, permitindo que a célula mantenha uma produção energética mínima suficiente para sobreviver, migrar e invadir, mesmo diante da perda de eficiência mitocondrial.
Quantas “vias de glicólise” existem em uma célula?
A glicólise não opera como uma única via linear dentro da célula, mas como milhares de unidades funcionais paralelas distribuídas no citosol. Cada “via de glicólise” pode ser entendida como um conjunto funcional completo de enzimas glicolíticas atuando simultaneamente. Em células mamárias tumorais, estima-se a existência de aproximadamente 10⁴ a 10⁵ vias glicolíticas ativas por célula, refletindo a elevada demanda energética e biossintética dessas células. Essa estimativa é sustentada por fundamentos bioquímicos claros:
A enzima hexoquinase 2 (HK2), as enzimas-chave da glicólise-6-fosfato, fosfofrutoquinase-1 (PFK1) e gliceraldeído-3-fosfato desidrogenase (GAPDH), estão presentes em dezenas a centenas de milhares de cópias por célula, permitindo que múltiplas moléculas de glicose sejam processadas simultaneamente. Esse arranjo garante um fluxo glicolítico contínuo, sustentado pela elevada captação de glicose mediada por GLUT1 e GLUT3, consolidando a glicólise como eixo central do metabolismo energético tumoral.
Quantas “unidades mitocondriais” existem?
A comparação entre glicólise-6-fosfato e o metabolismo mitocondrial não deve ser feito ao nível de “via a via”, mas ao nível de organela, considerando o número e a funcionalidade das mitocôndrias por cada célula.
Em células normais, é observado tipicamente uma presença de 1.000 a 2.000 mitocôndrias por célula, enquanto que em células tumorais agressivas esse número é frequentemente reduzido e situando-se em torno de número de 300 a 1.000 mitocôndrias por célula. Sendo que cada mitocôndria, por sua vez, contém milhares de complexos da cadeia respiratória (complexos I a V) e são organizados em múltiplas cadeias respiratórias em paralelo, produzindo um elevado potencial de produção de ATP por fosforilação oxidativa. Porém, apesar dessa complexidade interna, todas as mitocôndrias compartilham as mesmas dependências que são fundamentais e inescapáveis:
-presença de oxigênio molecular (O₂)
-manutenção de um potencial de membrana mitocondrial (ΔΨm) seja estável
-integridade estrutural das membranas interna e externa
-Intregridade estrutural de sua enzimas
-Presença de forma sustentavel de seus substratos
Qualquer comprometimento de um desses parâmetros, vai limitar de forma direta a eficiência oxidativa mitocondrial, impactando no balanço energético celular.
Mapeamento da Mitocôndria
| Parâmetro | Glicólise-6-fosfato | Mitocôndria |
| Unidades paralelas | 10⁴–10⁵ vias | 10³ mitocôndrias |
| Localização | Citosol | Organelas |
| Flexibilidade | Muito alta | Limitada |
| Dependência de O₂ | Nenhuma | Total |
| Vulnerabilidade | Baixa | Alta |
Comparativo metabólico entre os dois processos
Conclusão de vantagem estrutural:
Quando nescessario, a glicólise-6-fosfato vence pois tem maior número de unidades paralelas
Quando nescessario, a mitocôndria vence pois tem maior eficiência por unidade
Conclusão
Do ponto de vista da tradução funcional, entre a glicólise-6-fosfato e a mitocôndria operam sob uma arquiteturas bioenergéticas completamente distintas. Onde a glicólise-6-fosfato, funciona como se fossem milhares de pequenos geradores distribuídos pelo citosol, atuando em paralelo e de forma altamente redundante, enquanto que a mitocôndria funciona como se fosse um número limitado de geradores de grande porte, onde cada um é responsável por uma fração significativa da produção energética celular. Nesse contexto, a falha de um único “motor gerador” mitocondrial produz um grande impacto energético desproporcionalmente elevado, ao contrario que a perda ou ineficiência de alguns “pequenos geradores” glicolíticos resulta em um efeito mínimo sobre o fluxo energético global, é devido essa alta redundância do sistema e assimetria funcional que explica por que células tumorais, mesmo diante da menor eficiência energética da glicólise-6-fosfato, convergem para um metabolismo predominantemente glicolítico: pois trata-se de um arranjo já existente no metabolismo, que é mais robusto e resiliente, frente a instabilidades estruturais, flutuações redox e restrições bioenergéticas.
Referências:
Metabolismo energético do câncer: glicólise versus fosforilação oxidativa (Revisão)
https://www.spandidos-publications.com/10.3892/ol.2012.928
O papel do metabolismo da glicose reprogramado no câncer
https://www.mdpi.com/2218-1989/13/3/345
O câncer é uma doença metabólica?
https://www.sciencedirect.com/science/article/pii/S0002944013006536
Ocorrência de mutações mitocondriais em carcinoma de mama
https://bdtd.ibict.br/vufind/Record/UCS_aa006461a559ab5cfdd1d4138d617e59
Papel das alterações mitocondriais na progressão do câncer humano e na imunidade antitumoral
https://link.springer.com/article/10.1186/s12929-023-00956-w
Mitocôndrias e Câncer
https://www.cell.com/fulltext/S0092-8674(16)30908-4