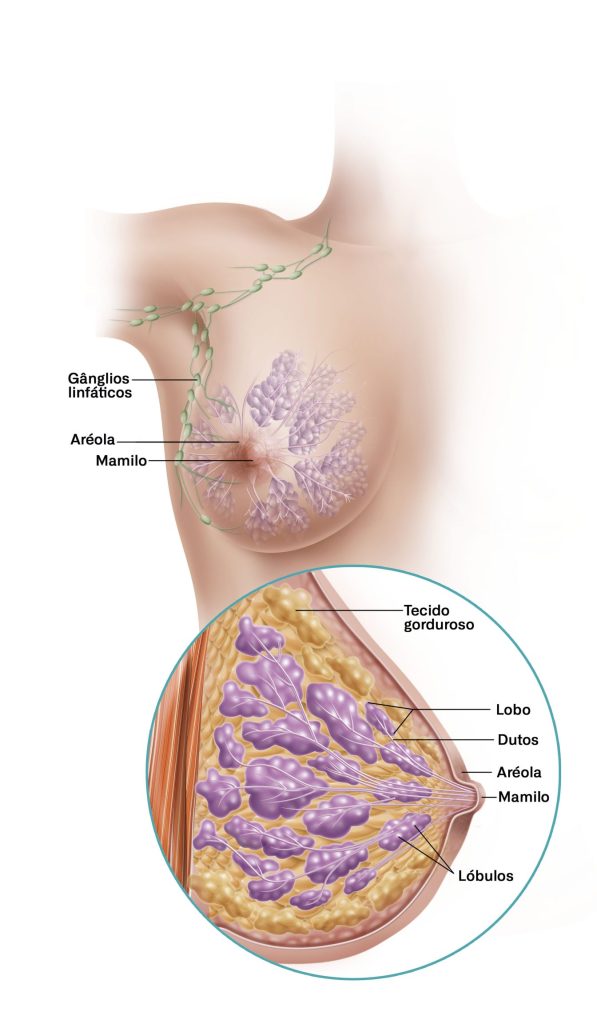
Breast Cancer: Contribution of GLUT3 to Metabolic Reprogramming in Breast Cancer
Parte 14 da série: Reprogramação Metabólica no Câncer de Mama
Fabio Henrique Amaral de Almeida
Pesquisador independente (Biomedicina), São luís, MA- Brasil
Endereço para correspondência (Para ajudar financeiramente a manter este canal)
Pix. 303 278 223 68
E-mail: ftorpedo3@gmail.com
postado em: 15/01/2026
revisado em:
Agradecimento.
Exclusivamente a DEUS.
Que me permite, por sua vontade, a sabedoria e o entendimento da verdade, assim como a todos aqueles que Ele julgar terem esse direito.
Resumo
A superexpressão do transportador de glicose 3 (GLUT3) em pacientes com câncer de mama está consistentemente associada a pior prognóstico e maior agressividade tumoral. A reprogramação anormal do metabolismo da glicose sustenta não apenas a sobrevivência celular, mas também favorece a progressão tumoral e a metástase. Nesse contexto, o microambiente tumoral exerce um papel ativo ao impor restrições metabólicas que selecionam células cancerígenas com maior capacidade de adaptação energética. Para atender à elevada demanda metabólica, células tumorais aumentam a expressão de transportadores de glicose, destacando-se o GLUT3, um transportador que é de alta afinidade e amplamente expresso em mamíferos e superexpresso em diversos tumores malignos. Evidências acumuladas demonstram que o GLUT3 é um determinante importante da metástase no câncer de mama, contribuindo diretamente para a reprogramação metabólica, a resistência ao estresse energético e a manutenção para esse fenótipo agressivo tumoral. E muito importante uma compreensão detalhada do papel do GLUT3 nesse processo, pois é essencial para elucidar os mecanismos bioenergéticos que sustentam a progressão do câncer de mama.
Palavras chave: câncer de mama, metabolismo celular, AMPK, glicose, GLUT1, GLUT3.
Abstract
Overexpression of glucose transporter 3 (GLUT3) in breast cancer patients is consistently associated with worse prognosis and greater tumor aggressiveness. Abnormal reprogramming of glucose metabolism sustains not only cell survival but also favors tumor progression and metastasis. In this context, the tumor microenvironment plays an active role by imposing metabolic constraints that select cancer cells with greater energy adaptation capacity. To meet the high metabolic demand, tumor cells increase the expression of glucose transporters, notably GLUT3, a transporter that is high-affinity and widely expressed in mammals and overexpressed in several malignant tumors. Accumulated evidence demonstrates that GLUT3 is an important determinant of metastasis in breast cancer, contributing directly to metabolic reprogramming, resistance to energy stress, and maintenance of this aggressive tumor phenotype. A detailed understanding of the role of GLUT3 in this process is very important, as it is essential to elucidate the bioenergetic mechanisms that underpin the progression of breast cancer.
Keywords: breast cancer, cellular metabolism, AMPK, glucose, GLUT1, GLUT3.
Introdução
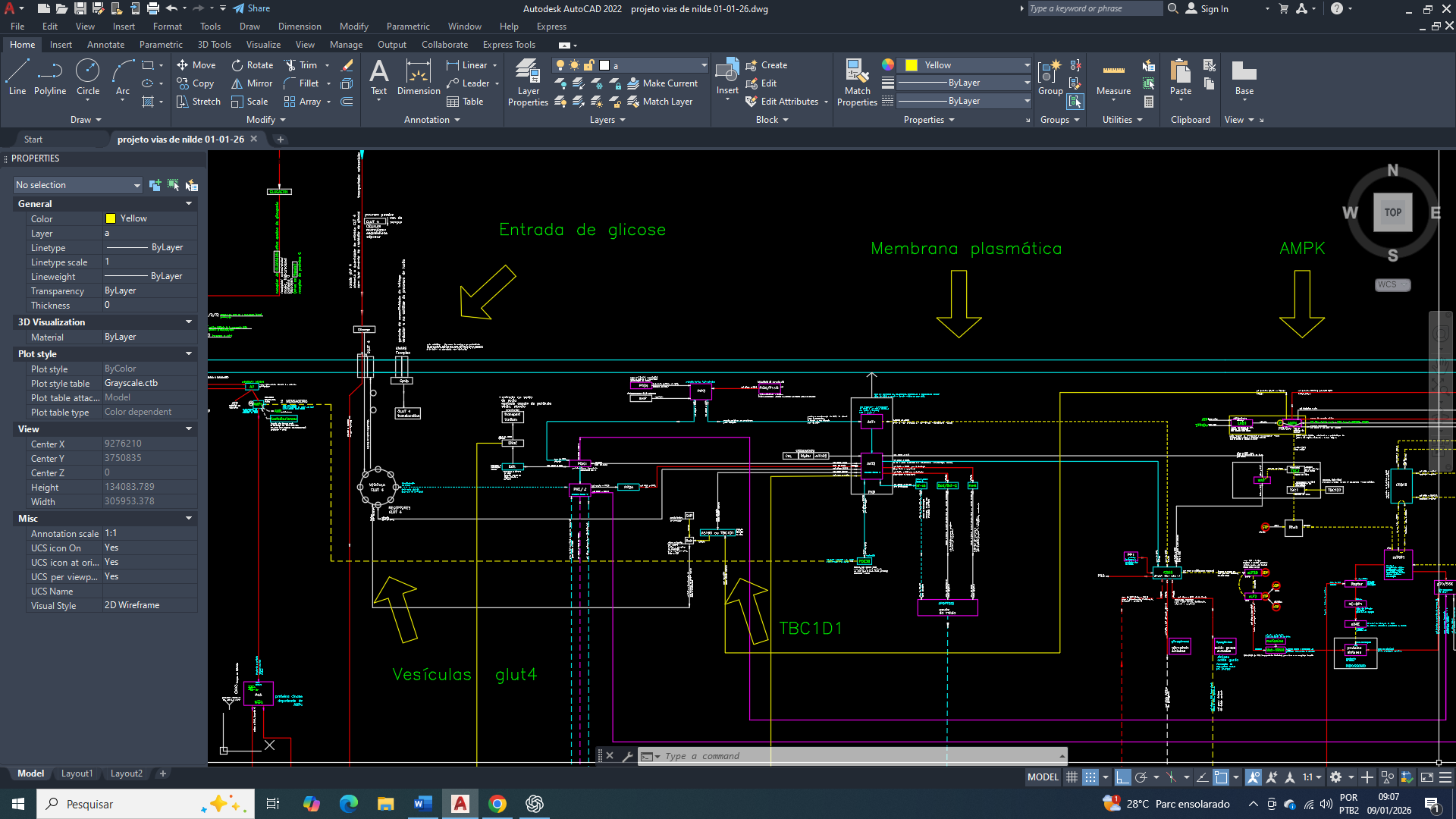
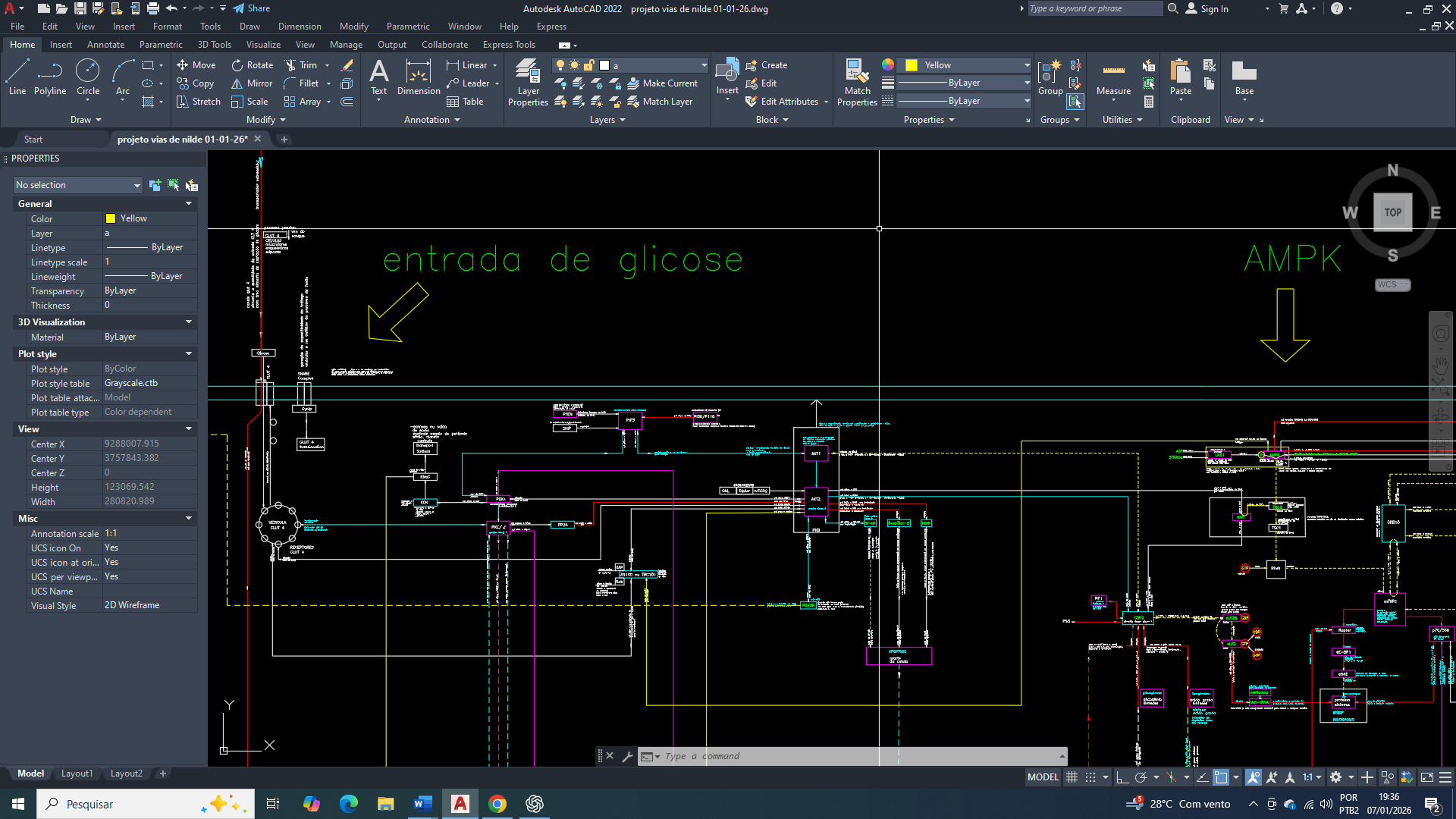
Amigos. O câncer de mama é uma doença metabolicamente heterogênea e é caracterizada por profundas adaptações bioenergéticas que sustentam a proliferação celular, a sobrevivência em condições adversas e uma progressão tumoral. Entre essas adaptações, a reprogramação do metabolismo da glicose representa uma das colunas de sustentação da biologia tumoral, permitindo que células cancerígenas, consiga manter a produção energética e biossintética mesmo em ambientes pobres em oxigênio e nutrientes. Esse fenótipo metabólico não é determinado apenas por alterações intrínsecas da célula tumoral, mas também pela influência dinâmica no microambiente tumoral, que impõe pressões seletivas responsáveis pela emergência de subpopulações mais agressivas. Nesse cenário, os transportadores de glicose desempenham papel de extrema importância, ao regular o fluxo glicolítico e a disponibilidade energética intracelular. Entre eles, se destaca o transportador de glicose 3 (GLUT3) por possuir uma alta afinidade pela glicose, permitindo uma captação eficiente mesmo em condições de escassez, essa característica é comum em tumores sólidos. A crescente evidência da associação entre a superexpressão do GLUT3, agressividade tumoral e metástase no câncer de mama também reforça a necessidade de compreender o seu papel na reprogramação metabólica e na manutenção do fenótipo maligno.
Afinidade extrema do GLUT3 (Glucose Transporter 3) pela glicose (uma vantagem adaptativa)
O GLUT3 possui Km muito baixo (~1 mM ou menor), significativamente inferior ao do GLUT1.
Isso permite que a célula tumoral continue captando a glicose mesmo em condições de escassez (hipóxia, competição metabólica, baixa perfusão) e Mantenha fluxo glicolítico contínuo, essencial para produção de ATP e intermediários biossintéticos. No câncer de mama, especialmente em regiões mal vascularizadas do tumor, o GLUT3 funciona como um mecanismo de sobrevivência energética de emergência.
A relação do GLUT3 com agressividade tumoral
Diversos estudos associam o aumento do GLUT3 a um fenótipos mais agressivos com maior potencial invasivo e metastático e também com Subtipos de câncer de mama com maior instabilidade metabólica (como triplo-negativo). Mais e necessário considerar que o GLUT3 no câncer de mama, não atua como transportador basal, mas como reforço metabólico seletivo, ativado quando o estresse energético esta ultrapassando a capacidade sustentada pelo GLUT1.
A integração do GLUT3 com o AMPK em resposta ao estresse
No contexto tumoral mamário a ativação da AMPK (por aumento de AMP/ATP) favorece a manutenção ou indução do GLUT3, permitindo que a célula evite um colapso energético e sustentando a glicólise-6-fosfato, mesmo sem que aja um suporte mitocondrial eficiente. Esse contexto se encaixa perfeitamente no conceito de função de sobrevivência celular (ftorpedo), que inicialmente tem a função de protetora, mas que a longo prazo sustenta um estado metabólico que favorece acúmulo de mutações, perda de identidade funcional e progressão tumoral irreversível.
A importância da independência de insulina para uma célula mamária tumoral
Assim como o GLUT1, o GLUT3 também é independente de insulina, essa caracteristica é fundamental no câncer de mama, onde a célula tumoral não depende da sinalização fisiológica normal, mas de vias de estresse e adaptação. Esse é o detalhe que mantém a sustentação da célula mamária tumoral, sempre viva e em constante desenvolvimento.
Diferença funcional entre GLUT1 e GLUT3 no câncer de mama
GLUT1: eixo dominante, basal, que mantém fluxo constante de glicose.
GLUT3: eixo adaptativo, entra em cena quando há queda energética severa, garantindo sobrevivência em condições extremas.
Obs. Se não houver essa diferença funcional, haveria uma entrada descontrolada de glicose na celula mamária, provocando um colapso na regulação do metabolismo e consequentemente a sua parada.
O Impacto da superexpressão de GLUT3, na perda da identidade celular
A superexpressão de GLUT3 reforça a existência de um metabolismo desdiferenciado cuja a priorização é a sobrevivência sobre a função tecidual mamária, isso a longo prazo, provoca através de mutações genéticas por adaptação, a consolidação de um fenótipo tumoral irreversível, metabolicamente dependente da glicose.
Em resumo: No câncer de mama, o GLUT3 desempenha um papel crítico como transportador de alta afinidade pela glicose, garantindo sobrevivência celular em condições de estresse energético extremo. Onde a sua ativação, é frequentemente associada à AMPK, sustenta a glicólise em ambientes hipóxicos e pobres em nutrientes, contribuindo para agressividade tumoral, perda da identidade funcional e progressão irreversível do fenótipo cancerígeno.
O que realmente define o “potencial de atuação” do GLUT1 vs GLUT3
O potencial de atuação do GLUT1 vs GLUT3, não deve ser definido apenas pela expressão gênica, pois essa definição, só indica a atuação final de cada um. O que realmente define qual será o potencial funcional de cada um, será o resultante da soma de quatro eixos:
- Estado energético (ATP/AMP)
- Intensidade da ativação da AMPK
- Tempo de permanência da AMPK ativa
- Capacidade do transportador compensar queda de substrato (Km)
Obs. Deus o pai, definil que os GLUT1 e GLUT3, sejam escolhidos de maneira automatica pelo metabolismo com base em custo-benefício energético e não por preferência molecular direta, pois isso causariam erros de prioridade.
Afinidade metabólica ≠ afinidade direta pela AMPK
O ponto mais relevante nesse contexto, é intender que GLUT1 e GLUT3 não têm afinidade direta pela AMPK (não são fosforilados por ela). A relação é funcional e contextual, mediada por um estado energético global, que irá indicar qual será a Reprogramação transcricional e Seleção adaptativa
Intensidade da AMPK (metabolismo normal)
Quando a uma Ativação leve a moderada da AMPK, isso produz um Contexto metabólico que indica que a uma concentração de ATP levemente reduzido, mais com a Glicólise ainda funcional e a Mitocôndria parcialmente eficiente.
A Resposta mais eficiente para esse contexto, é a Manutenção da estabilização do GLUT1, pois promoverá um Fluxo glicolítico contínuo evitando oscilações energéticas bruscas, nesse contexto de necessidade metabólica o GLUT3 não é necessário, pois o custo adaptativo não se justifica. Ou seja. A expressão do GLUT1 prevalecerá.
Intensidade da AMPK (metabolismo diferenciado)
Quando a uma ativação intensa e continua da AMPK, o Contexto metabólico é diferenciado. Pois quando o AMP fica elevado de forma significativa indica que há uma Glicose-6-fosfato limitante com Hipóxia ou falha mitocondrial relevante.
A Resposta mais eficiente para esse contexto, é o Recrutamento de programas de sobrevivência com a Indução de transportadores de altíssima afinidade glicolitica, sendo assim o GLUT3 passa a também a ser favorecido, pois O metabolismo “exige” uma captação mais eficiente, mesmo em glicose residual.
O tempo de exposição à AMPK: o fator decisivo
Este é o ponto mais negligenciado em estudos (pela comunidade científica) e é o mais importante.
Aqui nasce a função de sobrevivência celular ftorpedo
AMPK ativa por curto prazo (aguda), tem apenas a Função de proteção com o objetivo de restaurar a concentração de ATP. Nesse contexto, a única consequência será a ativação do GLUT1 para sustentar o sistema, impedindo uma reprogramação profunda, com um estado de reprogramação metabólica totalmente reversível. Ou seja. Isso é homeostase, não câncer.
Aqui morre a função de sobrevivência ftorpedo e nasce o câncer de mama.
O GLUT1 apresenta um Km em torno de ~1–3 mM, o que lhe confere eficiência moderada em condições de baixa disponibilidade de glicose, sendo funcional principalmente na manutenção do metabolismo basal, com compatibilidade apenas parcial com estados de ativação crônica da AMPK. Em contraste, o GLUT3 possui Km inferior a 1 mM, característica que garante eficiência muito alta na captação de glicose mesmo em concentrações extremamente baixas, tornando-o plenamente compatível com ambientes de estresse energético prolongado e ativação crônica da AMPK, nos quais a sobrevivência celular depende de máxima eficiência de captação do substrato. Mais se AMPK ficar ativa de forma crônica Indefinidamente, muda de Função de proteção para um estado de adaptação do metabolismo, que passará a aceita baixa eficiência como novo “normal”, tendo por Consequências: a indução sustentada do GLUT3, Reprogramação epigenética e Consolidação de fenótipo glicolítico extremo, pois a função de sobrevivência deixa de ser transitória e se torna estrutural.
O AMPK não é o culpado, (é o tempo).
Na lógica de decisão metabólica celular, uma queda leve de ATP associada a uma ativação curta da AMPK direciona a célula a manter o GLUT1 como eixo de estabilidade metabólica, preservando o fluxo glicolítico basal e a homeostase energética. Em contraste, uma redução acentuada e sustentada de ATP, acompanhada por ativação prolongada da AMPK, força a célula a recorrer ao GLUT3 como mecanismo de sobrevivência, capaz de garantir captação eficiente de glicose em condições extremas. Assim, não é a intensidade isolada da AMPK que define a indução do GLUT3, mas o tempo durante o qual o sistema metabólico é compelido a operar fora de sua faixa de eficiência, convertendo uma resposta transitória de adaptação em um estado funcional consolidado.
Obs. Uma célula que é depende cronicamente de GLUT3 por um tempo muito prolongado, não retorna mais ao seu estado normal, mesmo se o estresse cessar temporariamente.
Impacto na identidade celular
Na reprogramação metabólica celular, uma queda leve de ATP associada à ativação transitória da AMPK manterá o GLUT1 como o se eixo de estabilidade energética; em contraste, uma redução acentuada e persistente de ATP, acompanhada por ativação prolongada da AMPK, calsado pela ação da adenilato cinase, vai desloca o sistema para o GLUT3 como mecanismo de sobrevivência. Assim, não é a intensidade da AMPK ativa que vai determina essa escolha, mas o tempo durante o qual o metabolismo é forçado a operar fora de sua faixa de eficiência funcional. Esse estado adaptativo crônico vai favorecer o acúmulo progressivo de mutações genéticas, resultantes da adaptação metabólica sustentada, fazendo com que as células somáticas percam definitivamente a sua capacidade de retornar ao estado funcional normal das células mamárias, consolidando um fenótipo irreversível. Porque as mutações genéticas já se estabeleceram.
O GLUT3 não causa metástase, mas fornece a base energética máxima para isso
Nos subtipos mais agressivos do câncer de mama, especialmente o triplo-negativo (TNBC) e tumores de alto grau histológico, observa-se uma reprogramação metabólica profunda, caracterizada por ineficiência mitocondrial relativa, alta dependência glicolítica e estresse energético crônico. Esses tumores apresentam taxas elevadas de proliferação celular, o que aumenta drasticamente o consumo de ATP. Como a fosforilação oxidativa é funcionalmente limitada ou instável, ocorre uma redução persistente da razão ATP/AMP, levando à ativação sustentada da AMPK.
Nesses contextos agressivos, o GLUT1 encontra-se consistentemente superexpresso, atuando como o transportador basal dominante, responsável por garantir a sobrevivência celular, a proliferação tumoral local e a manutenção do efeito Warburg, de forma independente de insulina. Essa superexpressão de GLUT1 é um achado bem documentado e está associada a maior grau tumoral, maior captação em FDG-PET e pior prognóstico, refletindo sua importância na sustentação metabólica do tumor primário. Entretanto, apesar de essencial, o GLUT1 não é suficiente para sustentar sozinho as demandas energéticas impostas pelas condições extremas enfrentadas por células de câncer de mama agressivo, como hipóxia profunda, baixa perfusão, escassez de glicose e desprendimento celular.
É nesse cenário que se observa uma indução do GLUT3, cuja expressão é significativamente mais frequente em tumores mamários de alto grau, triplo-negativos e metastáticos. O GLUT3 possui afinidade extremamente elevada pela glicose, permitindo captação eficiente mesmo em concentrações residuais, compatíveis com os microambientes mais hostis do tumor e com os nichos pré-metastáticos. Evidências experimentais demonstram que a expressão de GLUT3 se correlaciona com maior invasividade, resistência à anoikis e capacidade de sobrevivência em condições de estresse metabólico severo, características centrais dos cânceres de mama mais agressivos.
A ativação crônica da AMPK, longe de exercer apenas um papel supressor, passa a funcionar como eixo adaptativo, favorecendo a expressão de transportadores de alta eficiência, como o GLUT3, e permitindo que células tumorais metabolicamente instáveis não entrem em colapso energético. Dessa forma, o GLUT3 não inicia a agressividade tumoral, mas viabiliza energeticamente fenótipos já agressivos, sustentando processos comprovadamente críticos para a progressão do câncer de mama, incluindo migração celular, invasão tecidual, sobrevivência na circulação sistêmica e colonização de órgãos secundários.
Assim, nos cânceres de mama mais agressivos, estabelece-se uma hierarquia metabólica funcional: o GLUT1 garante a base energética necessária para o crescimento e a sobrevivência tumoral, enquanto o GLUT3 permite a adaptação metabólica extrema, removendo a limitação energética que normalmente impediria a progressão tumoral e a metástase. Essa cooperação, sustentada por estresse energético crônico e ativação prolongada da AMPK, contribui para um fenótipo tumoral altamente invasivo, metabolicamente dependente da glicose e associado a pior prognóstico clínico, como amplamente observado em subtipos agressivos de câncer de mama
Conclusão
O potencial de atuação do GLUT1 e do GLUT3 não é definido por afinidade direta à AMPK, mas pela intensidade e, sobretudo, pelo tempo de ativação da AMPK. Ativações breves sustentam o GLUT1 como eixo basal; ativações intensas e crônicas selecionam o GLUT3, cuja altíssima afinidade pela glicose permite sobrevivência em estados energéticos colapsados, transformando uma resposta protetora em adaptação tumoral irreversível.
(Como ao pássaro o vaguear, como à andorinha o voar, assim a maldição sem causa não virá). (Provérbios 26:2) Na vida, tudo tem um porquê.
Referências
O transportador de glicose 3 é essencial para a sobrevivência de células cancerígenas da mama no cérebro.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6952949
Transportadores de glicose como alvo para terapia anticancerígena
https://www.mdpi.com/2072-6694/13/16/4184
High expression of GLUT1 and GLUT3 correlate with neoadjuvant chemotherapy ineffectiveness breast cancer patients
https://e-century.us/files/ijcep/9/9/ijcep0030634.pdf
Expressão dos transportadores de glicose GLUT1 e GLUT3 em cânceres de endométrio e de mama.